抑瘤素M (OSM): 白介素IL-6細(xì)胞因子家族成員,腫瘤、骨代謝、慢性炎癥性等疾病的潛力靶點(diǎn)?
日期:2023-09-03 08:41:33
細(xì)胞因子是由活化的免疫細(xì)胞產(chǎn)生的,包括促炎因子和抗炎因子,主要在免疫應(yīng)答過(guò)程中起著重要的調(diào)節(jié)作用。許多與炎癥相關(guān)的細(xì)胞因子被作為監(jiān)測(cè)腫瘤或免疫性疾病風(fēng)險(xiǎn)的新靶點(diǎn)。白介素IL-6家族作為重要的促炎因子,在炎癥反應(yīng)中的作用日益凸顯。近年來(lái),隨著IL-6家族被不斷深入地研究,OSM作為IL-6細(xì)胞因子家族成員之一,OSM在腫瘤形成及免疫調(diào)節(jié)中的作用引起了越來(lái)越多的關(guān)注。大量的證據(jù)顯示,OSM或許可以成為未來(lái)診斷、靶向治療腫瘤等疾病的潛力靶點(diǎn)分子!
1. 白介素IL-6家族
白介素-6(interleukin-6,IL-6)家族是一組細(xì)胞因子(點(diǎn)擊查看“細(xì)胞因子:白介素”專(zhuān)題),可以由多種細(xì)胞產(chǎn)生,它們以自分泌、旁分泌和內(nèi)分泌的形式在信號(hào)轉(zhuǎn)導(dǎo)中起作用。IL-6細(xì)胞因子家族包括IL-6、IL-11、IL-27、白血病抑制因子(LIF)、腫瘤抑制素M(OSM)、睫狀神經(jīng)營(yíng)養(yǎng)因子(CNTF)、心肌營(yíng)養(yǎng)因子1(CT-1)和心肌營(yíng)養(yǎng)蛋白樣細(xì)胞因子(CLCF 1)等。每個(gè)IL-6家族成員都在維持代謝、炎癥和免疫穩(wěn)態(tài)等生理調(diào)控中扮演著重要角色。眾多研究發(fā)現(xiàn),IL-6細(xì)胞因子家族成員在調(diào)控腫瘤的發(fā)生及發(fā)展過(guò)程中發(fā)揮著雙向作用,即抗腫瘤和促腫瘤作用。近年來(lái),IL-6細(xì)胞因子家族已成為腫瘤免疫學(xué)領(lǐng)域中的研究熱點(diǎn) [1-2]。
2. 什么是抑瘤素M(OSM)?
2.1 OSM的結(jié)構(gòu)
抑瘤素M(Oncostatin-M,OSM)屬于IL-6家族成員中的多效性細(xì)胞因子,在1986年首次從U937組織性淋巴瘤細(xì)胞中釋放并分離出來(lái),因其可抑制黑色素瘤細(xì)胞的增殖能力而得名。OSM基因位于22q12染色體上,由3個(gè)外顯子和2個(gè)內(nèi)含子組成,位置鄰近于LIF。OSM蛋白全長(zhǎng)含有239至263個(gè)氨基酸,折疊成一個(gè)與其他IL-6家族相似的四螺旋束長(zhǎng)鏈蛋白(圖1)[3]。人源OSM多肽含252個(gè)氨基酸殘基,N-末端是由25個(gè)氨基酸殘基構(gòu)成的信號(hào)肽,C-末端由32個(gè)氨基酸殘基構(gòu)成。對(duì)于OSM的轉(zhuǎn)錄和表達(dá),STAT5應(yīng)答元件有重要作用,IL-2、IL-3、EPO、GM-CSF等多種細(xì)胞因子能激活STAT5,從而使OSM高表達(dá);前列腺素E2/PG-E2能上調(diào)OSM轉(zhuǎn)錄 [3-5]。
2.2 OSM的表達(dá)與功能
OSM主要由激活的單核細(xì)胞、巨噬細(xì)胞、T淋巴細(xì)胞和樹(shù)突狀細(xì)胞分泌。OSM在維持造血微環(huán)境中起重要作用,它可通過(guò)調(diào)節(jié)G-CSF和SDF-1來(lái)維持祖細(xì)胞的造血功能。此外,OSM可調(diào)節(jié)中樞神經(jīng)系統(tǒng)的發(fā)育、肝臟再生、誘導(dǎo)心肌細(xì)胞的去分化、調(diào)節(jié)內(nèi)皮細(xì)胞產(chǎn)生其他細(xì)胞因子和生長(zhǎng)因子,并刺激血管生成。目前的體外研究已證明,OSM具有多種生物學(xué)活性,在造血、細(xì)胞生長(zhǎng)分化、炎癥反應(yīng)、代謝調(diào)控、腫瘤形成及免疫調(diào)節(jié)等方面發(fā)揮廣泛的作用 [3-6]。

圖1. OSM的結(jié)構(gòu) [3]
3. 什么是OSM的受體?
OSM與IL-6超家族內(nèi)的其他幾種細(xì)胞因子共有一個(gè)gp130受體亞單位,但其與gp130低親和力結(jié)合。也就是說(shuō),這些IL-6細(xì)胞因子的受體基本上都包含信號(hào)傳導(dǎo)受體亞基gp130糖蛋白。雖然gp130在所有細(xì)胞中都有表達(dá),但單獨(dú)存在的gp130無(wú)法與細(xì)胞因子結(jié)合。單個(gè)IL-6細(xì)胞因子家族成員的受體是細(xì)胞特異性的,這就意味著不同的細(xì)胞類(lèi)型,可以表達(dá)特定的IL-6細(xì)胞因子家族成員受體 [7-8]。
與其它IL-6家族細(xì)胞因子不同的是,OSM可以通過(guò)兩種不同的受體復(fù)合物發(fā)出信號(hào),OSM受體分為I型和Ⅱ型兩種。I型OSM受體(gp130/LIFRβ)是由一個(gè)gp130分子和一個(gè)LIF受體亞單位構(gòu)成的異源二聚體,既可以與LIF結(jié)合,也可以與gp130結(jié)合而啟動(dòng)信號(hào)轉(zhuǎn)導(dǎo)。Ⅱ型OSM受體(gp130/OSMRβ)是由一個(gè)gp130分子和一個(gè)OSM受體β亞單位構(gòu)成的異源二聚體,Ⅱ型受體具有OSM特異性,不能結(jié)合LIF及家族中的其他細(xì)胞因子(圖2) [8]。
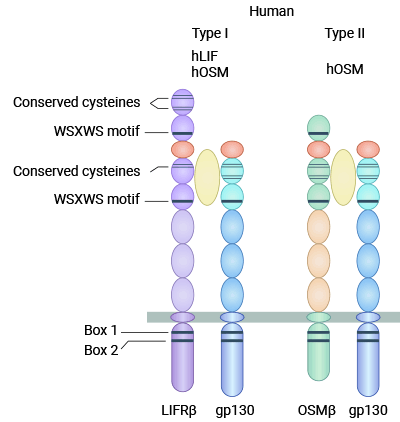
圖2. I型OSM受體(gp130/LIFRβ)和Ⅱ型OSM受體(gp130/OSMRβ)[8]
4. OSM結(jié)合受體調(diào)節(jié)JAK/STAT3和MAPK信號(hào)通路
SM與不同的兩種受體(gp130/LIFRβ;gp130/OSMRβ)結(jié)合后,會(huì)激活兩個(gè)不同的信號(hào)通路:JAK/STAT3通路和絲裂原活化蛋白激酶(MAPK)通路。這兩條通路在細(xì)胞內(nèi)扮演關(guān)鍵角色,參與調(diào)節(jié)細(xì)胞的多種生物學(xué)響應(yīng)(圖3) [9]。
具體而言,JAK/STAT3通路通過(guò)與gp130/OSM受體β亞單位復(fù)合體結(jié)合來(lái)啟動(dòng)。這一過(guò)程導(dǎo)致受體復(fù)合體二聚體化和相互磷酸化,激活Janus激酶(JAK)。JAK激酶活化導(dǎo)致gp130胞漿區(qū)的酪氨酸殘基磷酸化。然后,信號(hào)轉(zhuǎn)導(dǎo)因子和轉(zhuǎn)錄激活分子(STAT)識(shí)別這些磷酸化的受體,促使STAT分子自身被磷酸化。這種磷酸化狀態(tài)導(dǎo)致STAT形成同源和異源二聚體,并進(jìn)入細(xì)胞核作為活性轉(zhuǎn)錄因子,對(duì)特定基因的表達(dá)產(chǎn)生影響 [9]。
另一方面,gp130酪氨酸殘基磷酸化吸引酪氨酸磷酸酶,并為生長(zhǎng)因子受體結(jié)合蛋白2(Grb2)提供一個(gè)連接點(diǎn)。這樣一來(lái),Grb2可以連接到SOS蛋白(son of sevenless),激活SOS。SOS可以促使原癌基因c-ras的產(chǎn)物Ras蛋白從GDP釋放出來(lái),與GTP結(jié)合,進(jìn)而激活Ras。激活的Ras可以影響下游的Raf-1并激活它。Raf-1激活MAPK,并使其磷酸化并轉(zhuǎn)變?yōu)榛钚誀顟B(tài)。接著,激活的MAPK作用于細(xì)胞外信號(hào)調(diào)節(jié)蛋白激酶(ERK)1/2,使其活化。活化的ERK1/2進(jìn)入細(xì)胞核,作用于特定的轉(zhuǎn)錄因子,影響基因的表達(dá),因此發(fā)揮生物學(xué)活性 [9]。
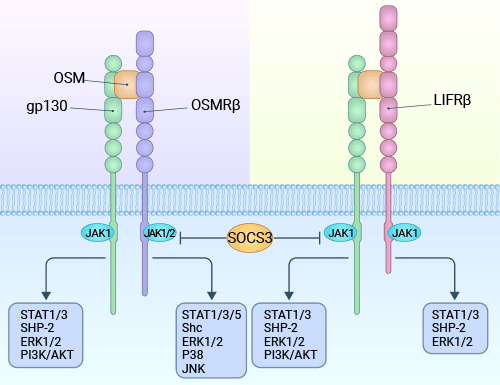
圖3. OSM通過(guò)兩種類(lèi)型的受體傳導(dǎo)信號(hào):I型受體(gp130/LIFRb)和II型受體(gp130/OSMRb)復(fù)合物 [9]
5. OSM在疾病中的作用
OSM作為一種多功能的細(xì)胞因子,研究者對(duì)于OSM的功能及其作用機(jī)制還存在許多未知之處。OSM最初是在黑色素瘤中被發(fā)現(xiàn)可以抑制腫瘤細(xì)胞生長(zhǎng)。隨后的研究逐漸揭示,OSM在器官發(fā)育、組織損傷與再生等方面也起到重要的調(diào)控作用。然而,在不同的環(huán)境下,OSM對(duì)細(xì)胞增殖或分化可能起著不同甚至完全相反的作用。目前,對(duì)于OSM在疾病中的研究主要集中在腫瘤、骨代謝、造血以及慢性炎癥性疾病方面。
5.1 OSM和腫瘤
OSM細(xì)胞因子在腫瘤中的作用并不是單一的。據(jù)報(bào)道,OSM所引起的這兩種完全相反的效應(yīng)與癌癥的發(fā)展階段或惡性程度之間存在一定的關(guān)聯(lián)。總的來(lái)說(shuō),在正常上皮細(xì)胞和一些早期腫瘤中,OSM發(fā)揮著抑制增殖、抑制癌癥進(jìn)展的作用;然而,在惡性程度較高或具有轉(zhuǎn)移傾向的腫瘤中,OSM的高表達(dá)則與不良預(yù)后相關(guān)。
以肝癌細(xì)胞為例,OSM通過(guò)激活STAT3信號(hào)途徑、上調(diào)癌基因c-Myc表達(dá)的同時(shí),也加速了細(xì)胞的衰老,從而最終表現(xiàn)為對(duì)肝癌細(xì)胞增殖的抑制作用(圖4) [9]。然而,在晚期腫瘤中,OSM通常更多地表現(xiàn)為促進(jìn)細(xì)胞增殖。具體地說(shuō),癌基因的激活所引發(fā)的細(xì)胞老化能夠限制異常細(xì)胞的增殖,同時(shí)保持組織的健康狀態(tài),這是機(jī)體的一種防御機(jī)制。然而,癌基因誘發(fā)的細(xì)胞老化需要特定蛋白(如p53或Rb)的參與,而這些蛋白在晚期癌細(xì)胞中通常受到損害。因此,這可能解釋了為何OSM在不同情況下會(huì)對(duì)肝癌增殖產(chǎn)生抑制或促進(jìn)的不同效應(yīng) [9-10]。
此外,OSM還與其它多種腫瘤相關(guān),包括黑色素瘤、肺癌細(xì)胞、乳腺癌、卵巢癌、胃癌等 [9-13]。例如,在乳腺癌中,OSM可以通過(guò)下調(diào)細(xì)胞膜E-cadherin表達(dá)、上調(diào)slug和snail表達(dá)而誘導(dǎo)癌細(xì)胞的間葉細(xì)胞表型 [14];在膠質(zhì)瘤中,OSM所調(diào)控的間葉細(xì)胞表型可以增加膠質(zhì)瘤細(xì)胞的遷移和侵襲能力,并且OSM表達(dá)水平同膠質(zhì)瘤的惡性程度和患者的低生存率明顯相關(guān) [15];OSM在TGFβ信號(hào)通路的協(xié)同作用下促進(jìn)胃腸胰神經(jīng)內(nèi)分泌腫瘤(GEP-NENs)細(xì)胞的遷移與侵襲 [16]。
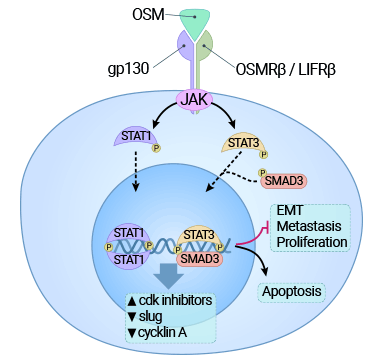
圖4. OSM受體的結(jié)合激活JAK3/STAT1途徑,并對(duì)癌細(xì)胞施加細(xì)胞毒作用 [9]
5.2 OSM和骨代謝相關(guān)疾病
已有研究證實(shí),LIF和OSM均可調(diào)節(jié)大鼠顱骨細(xì)胞成骨細(xì)胞的分化過(guò)程。在體外實(shí)驗(yàn)中,小鼠成骨母細(xì)胞與骨形態(tài)發(fā)生蛋白BMP-2結(jié)合后,堿性磷酸酶增加,這提示在骨膜骨形成過(guò)程中,OSM能誘導(dǎo)募集BMP或其他因子。另有報(bào)道,當(dāng)用小鼠OSM或人類(lèi)OSM刺激時(shí),小鼠顱骨外植體釋放膠原蛋白,并調(diào)節(jié)骨保護(hù)素(Osteoprotegerin,OPG)的表達(dá),從而抑制骨吸收活性。在類(lèi)風(fēng)濕關(guān)節(jié)炎患者的關(guān)節(jié),由滑膜細(xì)胞產(chǎn)生的OSM能間接降解蛋白質(zhì),引發(fā)炎性介質(zhì)PGE2產(chǎn)生,促進(jìn)基質(zhì)降解 [17-18]。
采用OSM/IL-1或OSM/TNF刺激模型,發(fā)現(xiàn)OSM在軟骨細(xì)胞和滑膜成纖維細(xì)胞中誘導(dǎo)MMP-10,激活軟骨細(xì)胞中的成纖維細(xì)胞活化蛋白-α,從而增強(qiáng)軟骨代謝 [18]。此外,OSM抗體可以調(diào)節(jié)關(guān)節(jié)炎小鼠體內(nèi)OSM與IL-1、TNF等細(xì)胞因子的相互作用,顯著減少膠原蛋白的分解,減輕炎癥反應(yīng),該發(fā)現(xiàn)為關(guān)節(jié)炎的治療提供了新思路 [19]。
5.3 OSM和炎癥性腸病
炎癥性腸病IBD包括克羅恩病(Crohn’s disease,CD)和潰瘍性結(jié)腸炎(Ulcerative colitis,UC)。OSM在炎性反應(yīng)中發(fā)揮著促炎或抗炎作用。活動(dòng)期CD患者結(jié)腸病變中OSM表達(dá)水平升高,但其也具有促進(jìn)上皮修復(fù)的功能 [20]。另有報(bào)道,IBD患者受損的腸道粘膜高表達(dá)OSM及其受體OSMR。同時(shí)OSM還能誘導(dǎo)IL-6、ICAM-1等炎癥因子的表達(dá)。對(duì)活動(dòng)期UC患者分別予不同抗TNF藥物治療,結(jié)果發(fā)現(xiàn)抗TNF-α抗體Infliximab治療無(wú)應(yīng)答組粘膜OSM表達(dá)水平最高 [21-22]。因此,通過(guò)治療性阻斷OSM,可減少I(mǎi)BD發(fā)病時(shí)腸粘膜表達(dá)的OSM等相關(guān)炎癥因子。這也表明OSM或可作為潛在的治療靶點(diǎn)。
5.4 OSM和心血管疾病
陸續(xù)研究提示OSM可能參與心血管疾病的發(fā)生發(fā)展。OSM可刺激內(nèi)皮細(xì)胞產(chǎn)生IL-6、G-CSF、GM-CSF及粘附分子,促進(jìn)中性粒細(xì)胞黏附 [23-24]。OSM還通過(guò)調(diào)節(jié)COX-2、血管生成素-2/ANG-2促進(jìn)微循環(huán)內(nèi)皮細(xì)胞血管生成 [23-24]。此外,OSM影響血管平滑肌細(xì)胞,如刺激細(xì)胞增殖和分泌VEGF、IL-6和COX-2 [25]。在動(dòng)脈粥樣硬化中,OSM通過(guò)影響內(nèi)皮細(xì)胞、血管平滑肌細(xì)胞和血管生成發(fā)揮復(fù)雜作用 [26-27]。在心肌梗塞和心室重構(gòu)中,OSM的作用也復(fù)雜,可通過(guò)多種機(jī)制改善心臟功能,但在某些情況下可能產(chǎn)生不利影響 [26-27]。
5.5 OSM和其它疾病
除此以外,OSM還和多種代謝免疫以及神經(jīng)性疾病相關(guān) [28-29]。例如,OSM可單獨(dú)或與其他GP130細(xì)胞因子共同作用,影響脂肪組織的正常代謝,造成脂代謝紊亂,進(jìn)而誘導(dǎo)糖尿病 [30];OSM可通過(guò)Ras/細(xì)胞外信號(hào)調(diào)節(jié)激酶(Ras/ERK)和STAT5信號(hào)通路調(diào)節(jié)CCAAT增強(qiáng)子結(jié)合蛋白β(C/EBPβ)的表達(dá)來(lái)抑制脂肪細(xì)胞的分化,引起脂代謝紊亂 [31-32];OSMR缺陷的小鼠表達(dá)TRPV1/P2X3/OSMRβ的神經(jīng)元也大量減少,OSMR缺陷的小鼠對(duì)機(jī)械刺激和熱刺激等各種刺激的反應(yīng)減退,提示OSM可作為神經(jīng)保護(hù)性細(xì)胞因子,為探索OSM在CNS疾病中的治療潛能提供了合理的基礎(chǔ) [33]。
6. OSM的臨床研究前景
OSM是一種兼具多種生物活性的白介素IL-6家族細(xì)胞因子。眾不同的是,OSM在體外和體內(nèi)通過(guò)OSMRβ/gp130(II型OSM受體)途徑得到特異性激活,從而施展其獨(dú)特作用。盡管關(guān)于其多樣生物學(xué)活性的作用機(jī)制以及與其他細(xì)胞因子之間的相互作用尚存待解之謎,但正是這些未知領(lǐng)域?yàn)檠芯空邆兲峁┝诉M(jìn)一步深入探索的機(jī)遇。盡管如此,根據(jù)當(dāng)前的研究成果,可以肯定的是,OSM激活劑以及其拮抗劑在臨床疾病,如腫瘤、骨代謝、慢性炎癥性等治療領(lǐng)域有望呈現(xiàn)出廣闊的應(yīng)用前景。
為鼎力協(xié)助科研和藥企人員針對(duì)OSM在多種免疫疾病和腫瘤中的臨床應(yīng)用研究,CUSABIO推出OSM活性蛋白(CSB-MP017260HU1),助力您在OSM機(jī)制方面的研究或其潛在臨床價(jià)值的探索。
Oncostatin-M (OSM)蛋白
● Recombinant Human OSM, partial (Active) (Code: CSB-MP017260HU1)
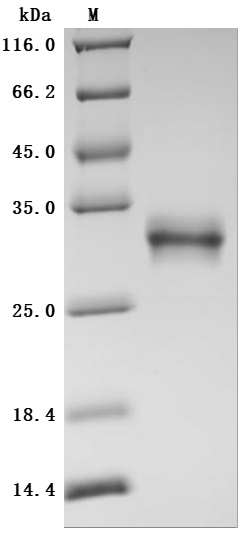
The high purity was greater than 95% as determined by SDS-PAGE.
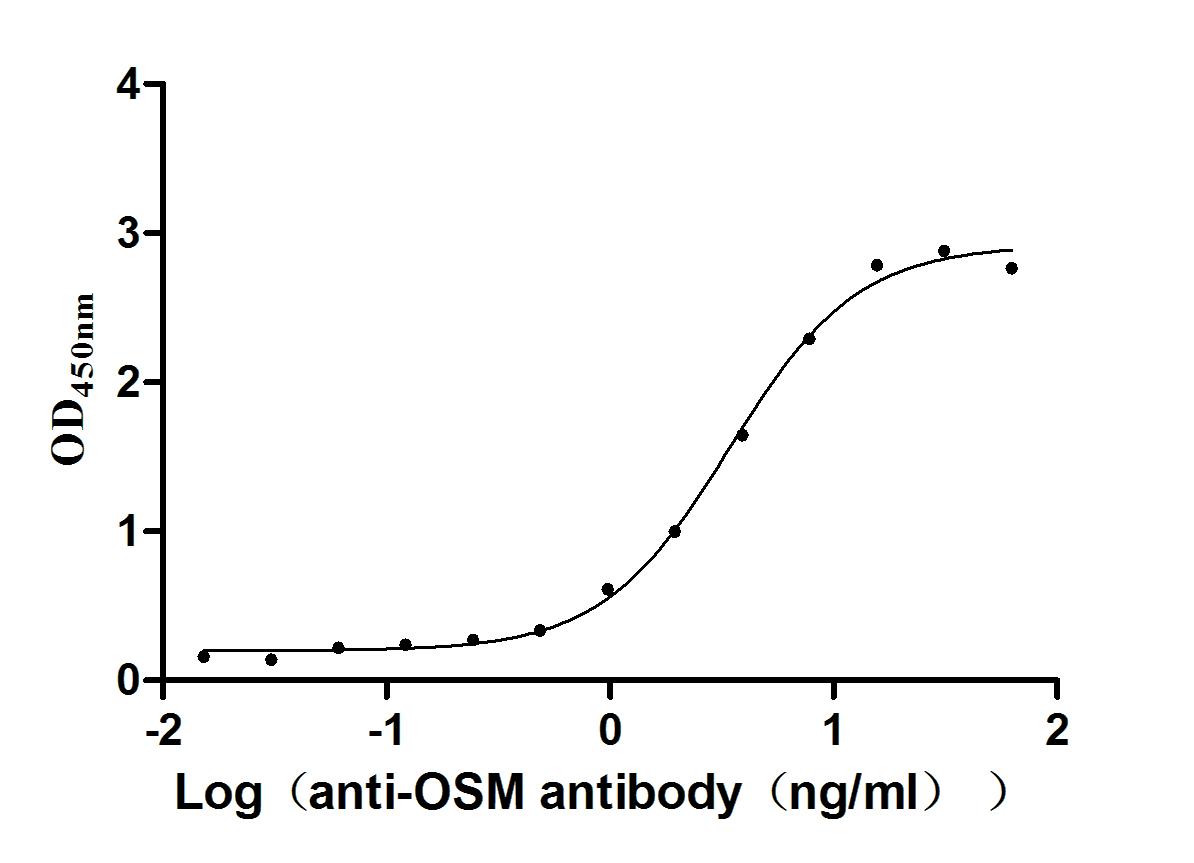
Immobilized Human OSM at 2μg/mL can bind Anti-OSM recombinant antibody (CSB-RA017260MA1HU). The EC50 is 3.048-3.860 ng/mL.
Oncostatin-M (OSM) 抗體
OSM Recombinant Monoclonal Antibody (Code: CSB-RA017260MA1HU)
參考文獻(xiàn):
[1] Tanaka, Toshio, Masashi Narazaki, and Tadamitsu Kishimoto. "Interleukin (IL-6) immunotherapy." cold spring harbor perspectives in biology 10.8 ( 2018): a028456.
[2] Jones, Simon A., Jürgen Scheller, and Stefan Rose-John. "Therapeutic strategies for the clinical blockade of IL-6/gp130 signaling." The Journal of clinical investigation 121.9 (2011): 3375-3383.
[3] Du, Qingqing, Yan Qian, and Weiwei Xue. "Molecular simulation of oncostatin M and receptor (OSM-OSMR) interaction as a potential therapeutic target for inflammatory bowel disease." Frontiers in Molecular Biosciences 7 (2020): 29.
[4] Bruce, A. Gregory, Peter S. Linsley, and Timothy M. Rose. "Oncostatin M." Progress in growth factor research 4.2 (1992): 157-170.
[5] Yoshimura, Akihiko, et al. "Mouse oncostatin M: an immediate early gene induced by multiple cytokines through the JAK-STAT5 pathway." The EMBO journal 15.5 (1996): 1055-1063.
[6] Botelho, Fernando M., et al. "Pulmonary expression of oncostatin M (OSM) promotes inducible BALT formation independently of IL-6, despite a role for IL- 6 in OSM-driven pulmonary inflammation." The Journal of Immunology 191.3 (2013): 1453-1464.
[7] Mosley, Bruce, et al. "Dual oncostatin M (OSM) receptors: cloning and characterization of an alternative signaling subunit conferring OSM-specific receptor activation." Journal of Biological Chemistry 271.51 (1996): 32635-32643.
[8] Grant, Susan L., and C. Glenn Begley. "The oncostatin M signalling pathway: reversing the neoplastic phenotype?" Molecular Medicine Today 5.9 (1999): 406-412.
[9] Masjedi, Ali, et al. "Oncostatin M: A mysterious cytokine in cancers." International Immunopharmacology 90 (2021): 107158.
[10] Caligiuri, Alessandra, et al. "Oncostatin M: From intracellular signaling to therapeutic targets in liver cancer." Cancers 14.17 (2022): 4211.
[11] M Stephens, Jacqueline, and Carrie M Elks. "Oncostatin M: potential implications for malignancy and metabolism. "Current pharmaceutical design 23.25 (2017): 3645-3657.
[12] Douglas, Andrea M., et al. "Oncostatin M induces the differentiation of breast cancer cells." International journal of cancer 75.1 (1998): 64-73.
[13] Junk, Damian J., et al. "Oncostatin M promotes cancer cell plasticity through cooperative STAT3-SMAD3 signaling." Oncogene 36.28 (2017): 4001-4013.
[14] West, N. R., J. I. Murray, and P. H. Watson. "Oncostatin-M promotes phenotypic changes associated with mesenchymal and stem cell-like differentiation in breast cancer." Oncogene 33.12 (2014): 1485-1494.
[15] Halfter, Hartmut, et al. "Inhibition of growth and induction of differentiation of glioma cell lines by oncostatin M (OSM)." Growth Factors 15.2 (1998): 135-147.
[16] Xue, Jingwen, et al. "TCF-3-mediated transcription of lncRNA HNF1A-AS1 targeting oncostatin M expression inhibits epithelial-mesenchymal transition via TGFβ signaling in gastroenteropancreatic neuroendocrine neoplasms." Aging (Albany NY) 13.10 (2021): 14065.
[17] Guihard, Pierre, et al. "Induction of osteogenesis in mesenchymal stem cells by activated monocytes/macrophages depends on oncostatin M signaling." Stem cells 30.4 (2012): 762-772.
[18] Hui, Wang, et al. "A model of inflammatory arthritis highlights a role for oncostatin M in pro-inflammatory cytokine-induced bone destruction via RANK/ RANKL." Arthritis Res Ther 7 (2004): 1-8.
[19] Le Goff, Benoit, et al. "Oncostatin M acting via OSMR, augments the actions of IL-1 and TNF in synovial fibroblasts." Cytokine 68.2 (2014): 101-109.
[20] West, Nathaniel R., et al. "Oncostatin M drives intestinal inflammation and predicts response to tumor necrosis factor-neutralizing therapy in patients with inflammatory bowel disease." Nature medicine 23.5 (2017): 579-589.
[21] Ito, Hiroaki. "IL-6 and Crohn's disease." Current Drug Targets-Inflammation & Allergy 2.2 (2003): 125-130.
[22] Verstockt, Sare, Bram Verstockt, and Séverine Vermeire. "Oncostatin M as a new diagnostic, prognostic and therapeutic target in inflammatory bowel disease (IBD)." Expert Opinion on Therapeutic Targets 23.11 (2019): 943-954.
[23] Albasanz-Puig, Adaia, et al. "Oncostatin M is expressed in atherosclerotic lesions: a role for Oncostatin M in the pathogenesis of atherosclerosis." Atherosclerosis 216.2 (2011): 292-298.
[24] Kubin, Thomas, et al. "The role of oncostatin M and its receptor complexes in cardiomyocyte protection, regeneration, and failure." International Journal of Molecular Sciences 23.3 (2022): 1811.
[25] Repovic, Pavle, et al. "Oncostatin-M induction of vascular endothelial growth factor expression in astroglioma cells." Oncogene 22.50 (2003): 8117- 8124.
[26] Gusakova, Anna M., et al. "Association of increased oncostatin M with adverse left ventricular remodeling in patients with myocardial infarction." Journal of Medical Biochemistry 41.4 (2022): 441.
[27] Han, Hui, et al. "Oncostatin M promotes infarct repair and improves cardiac function after myocardial infarction." American journal of translational research 13.10 (2021): 11329.
[28] Richards, Carl D. "The enigmatic cytokine oncostatin m and roles in disease." International Scholarly Research Notices 2013 (2013).
[29] Guo, Sen, et al. "Oncostatin M confers neuroprotection against ischemic stroke." Journal of Neuroscience 35.34 (2015): 12047-12062.
[30] Sanchez-Infantes, David, et al. "Oncostatin m is produced in adipose tissue and is regulated in conditions of obesity and type 2 diabetes. "The Journal of Clinical Endocrinology & Metabolism 99.2 (2014): E217-E225.
[31] Miyaoka, Yuichiro, et al. "Oncostatin M inhibits adipogenesis through the RAS/ERK and STAT5 signaling pathways." Journal of Biological Chemistry 281.49 (2006): 37913-37920.
[32] Zhou, Yue, et al. "Blockage of oncostatin M-induced LDL receptor gene transcription by a dominant-negative mutant of C/EBPβ." Biochemical Journal 397.1 (2006): 101-108.
[33] Morikawa, Yoshihiro. "Oncostatin M in the development of the nervous system." Anatomical science international 80 (2005): 53-59.













