ALPG:一種ALP同工酶“生殖細(xì)胞堿性磷酸酶”,多種癌癥中高度特異的細(xì)胞表面抗原!
日期:2023-10-17 17:06:59
近期,Nature子刊發(fā)布了一篇名為“Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours”的綜述文章,重點(diǎn)總結(jié)了解決CAR T細(xì)胞療法中靶向非腫瘤效應(yīng)相關(guān)毒性(OTOT)問(wèn)題的最新進(jìn)展 [1]。這項(xiàng)研究強(qiáng)調(diào),采用名為SynNotch CAR T的系統(tǒng)為OTOT問(wèn)題提供了可定制的解決方案。尤為引人矚目的是,一項(xiàng)針對(duì)表達(dá)ALPPL2-HER2的卵巢癌異種移植模型的原理性臨床前研究已經(jīng)成功驗(yàn)證該方案的有效性。ALPG(ALPPL2)作為ALP同工酶“生殖細(xì)胞堿性磷酸酶”,它是一種高度特異且可靶向腫瘤細(xì)胞的抗原,上述研究的發(fā)現(xiàn)更進(jìn)一步凸顯了ALPG(ALPPL2)的特殊地位。這些發(fā)現(xiàn)提示,ALPG(ALPPL2)可作為一個(gè)潛力的靶點(diǎn),在治療實(shí)體瘤的智能細(xì)胞療法中發(fā)揮重要作用!
1. 什么是堿性磷酸酶同工酶(ALP)?
堿性磷酸酶同工酶(Alkaline phosphatase,ALP)是一種水解酶,它能夠在堿性條件下去除各種磷酸化底物的磷酸基團(tuán),催化磷酸單酯水解。ALP在人體中分為組織非特異性堿性磷酸酶(TNAP)和組織特異性堿性磷酸酶(TSAP)。TSAP包括胎盤堿性磷酸酶(PLAP/ALPP)、腸道堿性磷酸酶(IAP/ALPi)、生殖細(xì)胞堿性磷酸酶(ALPG/ALPPL2/GCAP)。ALP廣泛存在于人體組織中,參與細(xì)胞周期、生長(zhǎng)、凋亡和信號(hào)轉(zhuǎn)導(dǎo)等多種過(guò)程 [2-4]。
ALP活性變化與多種疾病密切相關(guān),包括骨質(zhì)疏松、骨軟化、膽道阻塞、肝硬化和敗血癥等。同時(shí),ALP也在一些癌癥中作為重要的生物標(biāo)志物,如骨癌、胰腺癌、卵巢癌、乳腺癌以及前列腺癌。此外,ALP還能將一磷酸腺苷水解為細(xì)胞信號(hào)分子腺苷。因此,對(duì)ALP進(jìn)行高靈敏度檢測(cè)對(duì)于臨床診斷和生物醫(yī)學(xué)研究至關(guān)重要 [2-4]。
2. 什么是生殖細(xì)胞堿性磷酸酶(ALPG)?
2.1 ALPG的結(jié)構(gòu)
生殖細(xì)胞堿性磷酸酶(Alkaline phosphatase, germ cell type,ALPG)又叫NAGAO isozyme,GCALP,ALPPL,ALPPL2,編碼蛋白ALP-1,屬于一種堿性磷酸酶同工酶(Alkaline phosphatase,ALP)。人類的組織特異性堿性磷酸酶(TSAP)基因(ALPG/ALPPL2/GCAP、PLAP/ALPP、IAP/ALPi),都集中定位于在人類染色體2q34-q37區(qū)域。TSAP基因在結(jié)構(gòu)上幾乎是相同的,它們都包括11個(gè)外顯子和10個(gè)小的內(nèi)含子。ALPG、PLAP和IAP之間的同源性為90-98%,而TNAP與其他三者的同源性約為50%。與其它堿性磷酸酶一樣,ALPG通過(guò)糖基磷脂酰肌醇(GPI)錨定到細(xì)胞膜上(圖1)[5]。
2.2 ALPG的表達(dá)和功能
ALPG(ALPPL2/GCAP)在胚胎生殖細(xì)胞、一些腫瘤組織和胎盤中以低水平表達(dá),它本質(zhì)上是精原細(xì)胞堿性磷酸酶(ALP),在某些腫瘤中被視為腫瘤標(biāo)志物,如精原細(xì)胞瘤和卵巢癌。另一方面,GCAP在植入前的原始態(tài)胚胎干細(xì)胞表面出現(xiàn)短暫的高表達(dá),與IGFBP-1的mRNA相互作用,對(duì)原始態(tài)多能性轉(zhuǎn)錄因子CP2樣1(TFCP2L1)以及信號(hào)轉(zhuǎn)導(dǎo)和轉(zhuǎn)錄激活因子3(STAT3)的mRNA水平進(jìn)行調(diào)節(jié),從而參與調(diào)控胚胎干細(xì)胞的多能性狀態(tài)轉(zhuǎn)化過(guò)程 [6-8]。
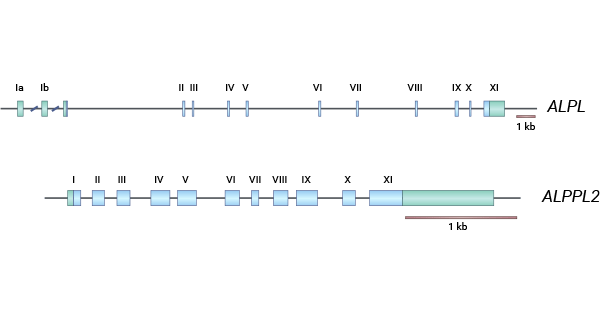
圖1. ALPG基因的結(jié)構(gòu) [5]
3. ALPG(ALPPL2)相關(guān)的信號(hào)通路
3.1 ALPG在原始態(tài)多能性建立和維持中的機(jī)制
目前,一項(xiàng)研究揭示ALPG(ALPPL2)在原始態(tài)多能性建立和維持中的重要作用。原始態(tài)(Naïve State)多能性研究已成為干細(xì)胞和重編程領(lǐng)域的焦點(diǎn)。現(xiàn)已鑒定的表面抗原在Naïve態(tài)的建立和維持過(guò)程中似乎并不起關(guān)鍵作用,其動(dòng)態(tài)變化和相關(guān)分子機(jī)制仍然不清楚 [6]。
研究通過(guò)系統(tǒng)性的蛋白質(zhì)組學(xué)和轉(zhuǎn)錄組學(xué)分析,確定了ALPPL2作為人原始態(tài)(Naïve state)多能干細(xì)胞首個(gè)功能性表面標(biāo)志物。更進(jìn)一步,證明了ALPPL2對(duì)于建立和維持原始多能性都是至關(guān)重要的。此外,實(shí)驗(yàn)數(shù)據(jù)表明ALPPL2可以與RNA結(jié)合蛋白IGF2BP1相互作用,穩(wěn)定原始多能性轉(zhuǎn)錄因子TFCP2L1和STAT3的mRNA水平,從而調(diào)控原始多能性。這一發(fā)現(xiàn)為進(jìn)一步改進(jìn)Naïve態(tài)多能干細(xì)胞的純化、分離,以及Naïve態(tài)誘導(dǎo)和培養(yǎng)體系提供了重要信息。Naïve態(tài)多能干細(xì)胞的可塑性和潛在能力使其成為干細(xì)胞治療的有力候選者。通過(guò)將它們誘導(dǎo)分化成需要的細(xì)胞類型,可以治療許多疾病和損傷,如心臟病、糖尿病和神經(jīng)退行性疾病(圖2) [6]。
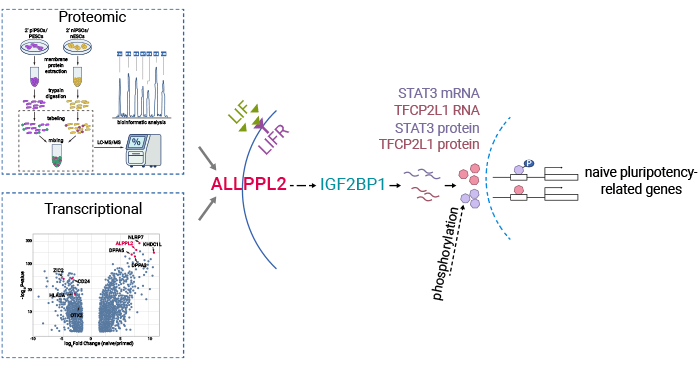
圖2. ALPG在原始態(tài)多能性建立和維持中的機(jī)制 [6]
3.2 ALPG在SynNotch CAR T電路中靶向腫瘤的機(jī)制
SynNotch CAR T是最新報(bào)道的一種“智能”腫瘤療法,它被設(shè)計(jì)用來(lái)識(shí)別主要存在于非惡性組織中的抗原 [8]。相關(guān)研究提示,ALPPL2可以通過(guò)SynNotch CAR T電路作為引導(dǎo)開關(guān),用于靶向其他腫瘤相關(guān)抗原,以最小化對(duì)靶向/非腫瘤組織的毒性作用。SynNotch CAR-T細(xì)胞通路在表達(dá)ALPPL2的實(shí)體瘤臨床前模型中顯示出增強(qiáng)的特異性,包括間皮瘤和卵巢癌。通過(guò)阻止CAR介導(dǎo)的強(qiáng)直信號(hào)傳導(dǎo),在臨床前模型中實(shí)現(xiàn)了優(yōu)越的腫瘤控制 [9-10]。
具體而言,一項(xiàng)研究利用ALPPL2這一特異性腫瘤抗原,將T細(xì)胞進(jìn)行改造,使其在感知到特異性腫瘤抗原ALPPL2時(shí),產(chǎn)生能夠識(shí)別并攻擊腫瘤細(xì)胞的CAR受體。這樣一來(lái),T細(xì)胞就能更有效地對(duì)抗腫瘤。研究中使用了三種CAR,分別定位于MCAM、mesothelin和HER2這三種腫瘤相關(guān)抗原,通過(guò)監(jiān)測(cè)GFP(綠色熒光蛋白)表達(dá)確認(rèn)CAR受體的存在。此外,實(shí)驗(yàn)中還涉及到兩種間皮瘤腫瘤細(xì)胞,分別是M28(上皮樣)和VAMT-1(肉瘤樣)。這些工程化T細(xì)胞能夠有效地殺死這些腫瘤細(xì)胞,而且這種殺傷作用是通過(guò)ALPPL2 SynNotch電路來(lái)調(diào)控的。這種電路能夠調(diào)控GFP的表達(dá),從而控制CAR的表達(dá)和T細(xì)胞的活性。因此,通過(guò)ALPPL2 SynNotch電路來(lái)控制CAR受體的表達(dá)和T細(xì)胞的活性,能夠高效地殺傷實(shí)體腫瘤細(xì)胞(圖3) [9]。
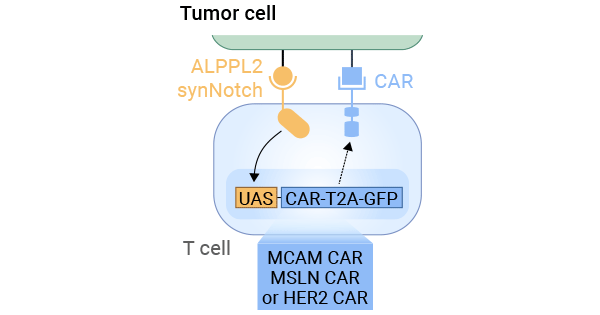
圖3. T細(xì)胞被改造,使其感知到ALPPL2時(shí)產(chǎn)生特定CARs,進(jìn)而識(shí)別并攻擊腫瘤細(xì)胞 [9]
4. ALPG(ALPPL2)在腫瘤中的作用
目前尚不清楚ALPG(ALPPL2)在疾病中的具體作用,但堿性磷酸酶在多種疾病中發(fā)揮重要作用,包括骨代謝疾病、腸道疾病和腫瘤等。因此,ALPPL2可能在這些疾病的發(fā)生和發(fā)展中發(fā)揮一定的作用,但需要進(jìn)一步的研究來(lái)揭示其具體機(jī)制和作用方式。現(xiàn)有的文獻(xiàn)報(bào)道主要集中在ALPG(ALPPL2)在一些腫瘤中的作用。
4.1 ALPG和胰腺癌
一項(xiàng)研究采用SELEX技術(shù)(一種可以從隨機(jī)單鏈核酸序列庫(kù)中篩選出特異性與靶物質(zhì)高度親和的核酸適配體(Aptamer)的技術(shù)),找到了一種能夠識(shí)別胰腺癌細(xì)胞的RNA分子SQ-2。然后,研究發(fā)現(xiàn)SQ-2分子的靶蛋白ALPG(ALPPL2),它在胰腺癌細(xì)胞中異常表達(dá)。利用RNA干擾技術(shù)降低了ALPPL2的表達(dá),且影響細(xì)胞生長(zhǎng)和侵襲。此外,SQ-2能夠識(shí)別ALPPL2,ALPPL2不僅存在于胰腺癌細(xì)胞的表面,還存在于細(xì)胞的分泌物中。缺乏早期敏感診斷標(biāo)志物是胰腺導(dǎo)管腺癌(PDAC)相關(guān)致死性的主要原因之一。這一發(fā)現(xiàn)提示,ALPPL2可能在基于血清和膜的胰腺導(dǎo)管腺癌(PDAC)診斷中具有重要作用 [11-13]。
4.2 ALPG和乳腺癌
在一項(xiàng)針對(duì)ER+乳腺癌患者的研究中,發(fā)現(xiàn)了與藥物阿那曲唑(Anastrozole)在血漿中濃度有關(guān)的基因變異。最重要的基因變異信號(hào)(rs11648166)位于SLC38A7基因附近,表明該基因編碼了安莫司唑的傳輸?shù)鞍住A硪粋€(gè)重要信號(hào)(rs28845026)位于ALPG(ALPPL2)基因附近,并與SLC38A7信號(hào)互相影響。這兩個(gè)SNP會(huì)影響這兩個(gè)基因的表達(dá)。值得注意的是,那些同時(shí)攜帶這兩個(gè)SNP變異的患者,其藥物濃度最高,SLC38A7基因表達(dá)最高,而ALPPL2基因表達(dá)最低。總結(jié)來(lái)說(shuō),這項(xiàng)研究揭示了一個(gè)新的基因SLC38A7,它編碼了阿那曲唑的轉(zhuǎn)運(yùn)蛋白,并發(fā)現(xiàn)了SLC38A7基因中的SNP與ALPPL2基因附近的SNP之間的相互作用,這些相互作用會(huì)影響轉(zhuǎn)運(yùn)蛋白的表達(dá)以及阿那曲唑在血漿中的濃度 [7]。
4.3 ALPG和間皮瘤
研究發(fā)現(xiàn)ALPG(ALPPL2)在間皮瘤中廣泛表達(dá),覆蓋多種亞型,并表現(xiàn)出高度組織特異性。間皮瘤是一種無(wú)法治愈的腫瘤,可分為上皮型、雙相型和肉瘤型。研究人員通過(guò)在活體間皮瘤細(xì)胞和正常細(xì)胞上進(jìn)行抗體展示篩選,抗體M25特異地識(shí)別ALPPL2。為了評(píng)估ALPPL2靶向治療的潛力,研究人員開發(fā)了ALPPL2靶向的抗體-藥物結(jié)合物,展示了其在體外和體內(nèi)對(duì)間皮瘤的強(qiáng)效和特異性腫瘤殺傷作用。這些發(fā)現(xiàn)為間皮瘤治療提供了新的方向和策略 [14]。
4.4 ALPG和胃癌
研究使用免疫組化技術(shù)和生物信息學(xué)來(lái)分析ALPG(ALPPL2)在胃組織和鄰近正常組織中的表達(dá),并評(píng)估其在早期檢測(cè)和預(yù)測(cè)胃腺癌預(yù)后的潛力。研究結(jié)果顯示,ALPPL2在胃腺癌組織中的表達(dá)顯著增加,并且是一個(gè)獨(dú)立的因素,可以提供可靠的胃腺癌患者預(yù)后信息。高表達(dá)的ALPPL2與進(jìn)展期TNM分期和高表達(dá)的HER-2相關(guān)。因此,ALPPL2有潛力成為揭示胃癌預(yù)后信息的生物標(biāo)志物 [15]。
4.5 ALPG和其它腫瘤
ALPG(ALPPL2)在癌癥領(lǐng)域引起了廣泛的關(guān)注,特別是在精原細(xì)胞瘤的早期檢測(cè)和基于血液樣本的診斷方法中 [6]。已有研究發(fā)現(xiàn),ALPPL2在多種實(shí)體腫瘤中表達(dá)較高,包括卵巢、子宮內(nèi)膜和睪丸癌等 [6]。此外,ALPPL2在肺癌、膀胱癌、卵巢癌、黑色素瘤、子宮癌、腎癌、前列腺癌、中樞神經(jīng)系統(tǒng)腫瘤、結(jié)直腸癌、淋巴瘤和白血病等多種腫瘤中也有表達(dá) [6, 16-19]。然而,ALPPL2在這些腫瘤中的表達(dá)和功能可能受到多種因素的影響,包括腫瘤亞型、患者群體和實(shí)驗(yàn)條件等。因此,對(duì)于每一種腫瘤類型,都需要需要進(jìn)一步的研究和驗(yàn)證,以深入探究ALPPL2在該特定腫瘤中的角色。
5. ALPG(ALPPL2)臨床應(yīng)用前景
目前,已有一款靶向ALPG(ALPPL2)的臨床項(xiàng)目在研(SGN-ALPV)。SGN-ALPV是一種創(chuàng)新的vedotin ADC,它借助高度特異性的抗體識(shí)別ALPG(ALPPL2)和ALPP,并釋放細(xì)胞毒劑MMAE,從而引發(fā)癌細(xì)胞的有絲分裂阻滯、凋亡和免疫原性細(xì)胞死亡 [20]。臨床前研究結(jié)果表明,SGN-ALPV在卵巢、肺、胰腺和胃癌等模型中表現(xiàn)出卓越的抗腫瘤活性,包括對(duì)不同ALPG(ALPPL2)和ALPP表達(dá)水平的抗腫瘤效應(yīng) [20]。總結(jié)而言,ALPG(ALPPL2)是一種與多種腫瘤相關(guān)的生殖細(xì)胞堿性磷酸同工酶。盡管ALPG(ALPPL2)的確切功能和調(diào)控機(jī)制尚未完全闡明,但它可能在多種腫瘤中發(fā)揮關(guān)鍵作用。未來(lái)的研究將有助于深入了解ALPG(ALPPL2)的功能,以及其在腫瘤治療領(lǐng)域的潛在應(yīng)用價(jià)值。
為鼎力協(xié)助科研和藥企人員針對(duì)ALPG(ALPPL2)的在腫瘤中的臨床應(yīng)用研究,CUSABIO推出ALPG活性蛋白(Code:CSB-MP001633HU),助力您在ALPG機(jī)制方面的研究或其潛在臨床價(jià)值的探索。
華美 CUSABIO ALPG 蛋白
Recombinant Human Alkaline phosphatase, germ cell type(ALPG) (Active) Code: CSB-MP001633HU
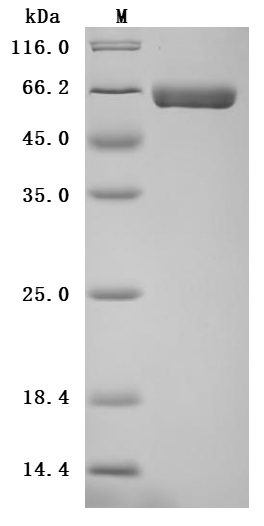
The high purity is greater than 95% as determined by SDS-PAGE.

Immobilized Human ALPG at 2μg/mL can bind Anti-ALPG recombinant antibody (CSB-RA001633MA1HU). The EC50 is 14.09-23.17 ng/mL.
華美 CUSABIO ALPG 抗體
ALPG Recombinant Monoclonal Antibody (Code: CSB-RA001633MA1HU)
參考文獻(xiàn):
[1] Flugel, Christian L., et al. "Overcoming on-target, off-tumour toxicity of CAR T cell therapy for solid tumours." Nature Reviews Clinical Oncology 20.1 (2023): 49-62.
[2] Sharma, Ujjawal, Deeksha Pal, and Rajendra Prasad. "Alkaline phosphatase: an overview." Indian journal of clinical biochemistry 29 (2014): 269-278.
[3] Orimo, Hideo. "The mechanism of mineralization and the role of alkaline phosphatase in health and disease." Journal of Nippon Medical School 77.1 (2010): 4-12.
[4] Zhang, Hongyi, et al. "Recent progress of fluorescent probes for the detection of alkaline phosphatase (ALP): A review." Dyes and Pigments 194 (2021): 109569.
[5] Buchet, René, José Luis Millán, and David Magne. "Multisystemic functions of alkaline phosphatases." Phosphatase modulators (2013): 27-51.
[6] Bi, Yan, et al. "Identification of ALPPL2 as a naive pluripotent state-specific surface protein essential for human naive pluripotency regulation." Cell Reports 30.11 (2020): 3917-3931.
[7] Dudenkov, Tanda M., et al. "Anastrozole Aromatase Inhibitor Plasma Drug Concentration Genome‐Wide Association Study: Functional Epistatic Interaction Between SLC 38A7 and ALPPL 2." Clinical Pharmacology & Therapeutics 106.1 (2019): 219-227.
[8] Su, Yang, et al. "ALPPL2 is a highly specific and targetable tumor cell surface antigen." Cancer research 80.20 (2020): 4552-4564.
[9] Hyrenius-Wittsten, Axel, et al. "SynNotch CAR circuits enhance solid tumor recognition and promote persistent antitumor activity in mouse models." Science translational medicine 13.591 (2021): eabd8836.
[10] Hyrenius-Wittsten, Axel, et al. "Enhanced solid tumor recognition and T cell stemness with SynNotch CAR circuits." bioRxiv (2021): 2021-01.
[11] Shin, Hye-Su, et al. "Alppl2 is a potential diagnostic biomarker for pancreatic cancer-derived extracellular vesicles." Molecular Therapy-Methods & Clinical Development 15 (2019): 204-210.
[12] Dua, Pooja, et al. "Alkaline phosphatase ALPPL-2 is a novel pancreatic carcinoma-associated protein." Cancer research 73.6 (2013): 1934-1945.
[13] Dua, Pooja, Soyoun Kim, and Dong-ki Lee. "Alppl2 aptamer-mediated targeted delivery of 5-fluoro-2′-deoxyuridine to pancreatic cancer." nucleic acid therapeutics 25.4 (2015): 180-187.
[14] Li, Yuyang, Min Liu, and Songbo Xie. "Harnessing phage display for the discovery of peptide-based drugs and monoclonal antibodies." Current Medicinal Chemistry 28.40 (2021): 8267-8274.
[15] Liu, Shuang, et al. "High expression of ALPPL2 is associated with poor prognosis in gastric cancer." Human Pathology 86 (2019): 49-56.
[16] Lei, Sibei, et al. "ALPPL2‐binding peptide facilitates targeted mRNA delivery for efficient hepatocellular carcinoma gene therapy." Advanced Functional Materials 32.43 (2022): 2204342.
[17] Zhou, Shuchang, et al. "Present Status and Advances in Chimeric Antigen Receptor T Cell Therapy for Glioblastoma." Frontiers in Bioscience-Landmark 28.9 (2023): 206.
[18] Chen, Laurence C., Andrew J. Hou, and Yvonne Y. Chen. "Getting better mileage with logically primed CARs." Med 2.7 (2021): 785-787.
[19] Halder, Kuntal, et al. "Abstract A041: Extracellular vesicle based ALPPL2 and THBS2 as biomarkers for monitoring disease burden in patients with pancreatic cancer." Cancer Research 82.22_Supplement (2022): A041-A041.
[20] Lakhani, Nehal J., et al. "Phase 1 study of SGN-ALPV, a novel, investigational vedotin antibody–drug conjugate directed to ALPP/ALPPL2 in advanced solid tumors (SGNALPV-001, trial in progress)." (2022): TPS3159-TPS3159.












