靶向TNFRSF13B:雙靶點(diǎn)策略引領(lǐng)腫瘤與自身免疫病治療新焦點(diǎn)
日期:2025-11-05 17:31:14
TNFRSF13B(TACI),一個(gè)在免疫調(diào)控中扮演核心角色的分子,因其功能的多樣性,成為了跨界攻克腫瘤與自身免疫病的新焦點(diǎn)。當(dāng)前的研究突破,正密集涌現(xiàn)于旨在實(shí)現(xiàn)“1+1>2”療效的雙靶點(diǎn)創(chuàng)新策略之中。本文將從其信號(hào)通路與疾病機(jī)制出發(fā),系統(tǒng)梳理這一潛力靶點(diǎn)的最新研發(fā)全景。
1. TNFRSF13B(TACI)研究背景
TNFRSF13B(腫瘤壞死因子受體超家族成員13B),又稱 TACI(跨膜激活因子及鈣調(diào)親環(huán)素配體相互作用因子),是TNF受體超家族的重要成員。該基因定位于人類染色體17p11.2,其編碼的TACI蛋白在免疫調(diào)節(jié)、B細(xì)胞穩(wěn)態(tài)維持及多種疾病進(jìn)程中發(fā)揮核心作用。TACI能與APRIL(增殖誘導(dǎo)配體)和BAFF(B 細(xì)胞活化因子)結(jié)合,調(diào)控B細(xì)胞的增殖、分化與存活,對(duì)體液免疫穩(wěn)態(tài)的維持至關(guān)重要 [2,4]。
在正常條件下,TACI 激活后可促進(jìn)B細(xì)胞向漿細(xì)胞分化,實(shí)現(xiàn)免疫球蛋白類別轉(zhuǎn)換和抗體生成 [2,6]。然而,TNFRSF13B表達(dá)異常或突變可破壞免疫平衡,與多種疾病相關(guān),包括慢性淋巴細(xì)胞白血病(CLL)、黑色素瘤、狼瘡腎炎(LN)、兒童多系統(tǒng)炎癥綜合征(MIS-C)及常見變異型免疫缺陷病(CVID)等 [1,4,6,7,8]。
2. TNFRSF13B(TACI)作用機(jī)制
2.1 免疫調(diào)節(jié)機(jī)制
TNFRSF13B的主要功能是通過與APRIL、BAFF等配體結(jié)合調(diào)控B細(xì)胞免疫應(yīng)答。在炎癥微環(huán)境中,膜結(jié)合型APRIL與B細(xì)胞表面的 TACI相互作用,可誘導(dǎo)巨噬細(xì)胞釋放IL-8、MMP-9等炎癥介質(zhì),促進(jìn)慢性炎癥反應(yīng) [2]。類風(fēng)濕關(guān)節(jié)炎患者滑膜組織中TNFRSF13B與APRIL的共表達(dá)水平與炎癥程度正相關(guān),提示TACI-APRIL軸在慢性炎癥持續(xù)過程中具有關(guān)鍵作用 [2]。
在正常免疫過程中,TACI的激活促進(jìn)B細(xì)胞成熟與抗體生成。當(dāng)TNFRSF13B出現(xiàn)突變(如 A181E)時(shí),其與配體結(jié)合能力下降,導(dǎo)致B細(xì)胞活化障礙,免疫球蛋白生成減少,進(jìn)而引發(fā)常見變異型免疫缺陷病(CVID)。此外,在MIS-C患者中檢測(cè)到TNFRSF13B罕見致病性變異,這些變異會(huì)破壞免疫穩(wěn)態(tài),加劇炎癥反應(yīng) [8]。
2.2 腫瘤調(diào)控機(jī)制
在腫瘤中,TNFRSF13B可通過調(diào)控細(xì)胞存活、增殖及腫瘤免疫微環(huán)境發(fā)揮作用。在慢性淋巴細(xì)胞白血病(CLL)向Richter綜合征(RS)轉(zhuǎn)化過程中,TNFRSF13B表達(dá)上調(diào),與腫瘤微環(huán)境中APRIL、BAFF結(jié)合后激活NF-κB通路,促進(jìn)腫瘤細(xì)胞增殖 [6]。在黑色素瘤中,其高表達(dá)促進(jìn)調(diào)節(jié)性T細(xì)胞(Treg)富集,通過JAK-STAT通路增強(qiáng)免疫抑制功能,抑制效應(yīng)T細(xì)胞活性,從而助推腫瘤免疫逃逸 [7]。此外,在乳腺癌中,TNFRSF13B表達(dá)與乳腺密度和癌癥風(fēng)險(xiǎn)呈負(fù)相關(guān) [3,5]。
3. TNFRSF13B(TACI)相關(guān)信號(hào)通路
3.1 NF-κB信號(hào)通路
NF-κB是TNFRSF13B的核心下游通路。當(dāng)TACI與配體結(jié)合后,激活I(lǐng)KK復(fù)合物,誘導(dǎo)IκB降解并釋放NF-κB進(jìn)入細(xì)胞核,調(diào)控IL-6、Bcl-2等靶基因表達(dá),促進(jìn)細(xì)胞存活與炎癥反應(yīng) [2,6]。在CLL/RS及狼瘡腎炎(LN)中,該通路持續(xù)活躍,驅(qū)動(dòng)疾病進(jìn)展 [4,6]。
3.2 JAK-STAT信號(hào)通路
TNFRSF13B激活JAK3-STAT5通路,促進(jìn)Treg分化與免疫抑制功能。在黑色素瘤中,TNFRSF13B的高表達(dá)與STAT5磷酸化水平顯著相關(guān),STAT5抑制可恢復(fù)效應(yīng)T細(xì)胞活性 [7]。此外,MIS-C中的TNFRSF13B變異可能通過影響JAK-STAT通路,導(dǎo)致免疫細(xì)胞異常激活 [8]。
3.3 其他通路
TACI還通過激活PI3K-AKT通路促進(jìn)B細(xì)胞代謝與存活,在CLL細(xì)胞中增強(qiáng)耐藥性 [2,6];同時(shí)與TGF-β通路協(xié)同,促進(jìn)腫瘤上皮-間質(zhì)轉(zhuǎn)化(EMT),加劇腫瘤轉(zhuǎn)移 [5,7]。
4. TNFRSF13B(TACI)相關(guān)疾病
4.1 血液系統(tǒng)疾病
4.1.1 慢性淋巴細(xì)胞白血病(CLL)與 Richter 綜合征(RS)
CLL是一種常見的成熟B細(xì)胞惡性腫瘤,其中約2-10%的患者最終進(jìn)展為RS。研究表明,RS患者腫瘤細(xì)胞中TNFRSF13B表達(dá)顯著上調(diào),且其水平與NF-κB通路活性呈正相關(guān) [6]。TACI通過與單核細(xì)胞分泌的APRIL、BAFF結(jié)合,促進(jìn)腫瘤細(xì)胞存活和炎癥因子釋放,從而加速CLL向RS的轉(zhuǎn)化 [6]。此外,高表達(dá)TNFRSF13B的患者預(yù)后較差,生存期明顯縮短,提示其可作為潛在生物標(biāo)志物。
4.1.2 兒童多系統(tǒng)炎癥綜合征(MIS-C)
MIS-C是SARS-CoV-2感染后的嚴(yán)重炎癥反應(yīng)綜合征。約6.7%的患者存在 TNFRSF13B致病性變異,主要為移碼突變(如 c.20-idup)[8]。這些變異導(dǎo)致TACI結(jié)構(gòu)與信號(hào)轉(zhuǎn)導(dǎo)功能受損,破壞B細(xì)胞調(diào)控,從而引發(fā)異常炎癥反應(yīng)與多器官損傷。攜帶突變的患者更易出現(xiàn)休克與心臟功能障礙,表明TNFRSF13B是影響病情嚴(yán)重程度的重要分子標(biāo)志 [8]。
4.2 自身免疫病
4.2.1 狼瘡腎炎(LN)
LN是系統(tǒng)性紅斑狼瘡的嚴(yán)重并發(fā)癥。研究顯示,患者尿沉渣中可檢測(cè)到TNFRSF13B mRNA,其表達(dá)頻率與LN類型及病情活動(dòng)度相關(guān) [4]。在III/IV型LN中檢出率顯著高于V型(42.85% vs. 0%)。TACI-BAFF/APRIL軸激活NF-κB通路后,誘導(dǎo)炎癥因子IL-6、TNF-α及趨化因子CCL21表達(dá),促進(jìn)免疫細(xì)胞浸潤(rùn)和免疫復(fù)合物沉積 [4]。此外,尿TACI表達(dá)水平與SLEDAI-2K 指數(shù)、補(bǔ)體C4水平密切相關(guān),提示其作為L(zhǎng)N的非侵入性生物標(biāo)志物具有潛在價(jià)值 [4]。
4.3 惡性腫瘤
4.3.1 黑色素瘤
黑色素瘤是最具侵襲性的皮膚腫瘤。TNFRSF13B在黑色素瘤組織中高表達(dá),并與淋巴結(jié)轉(zhuǎn)移密切相關(guān) [7]。TACI可通過JAK-STAT通路上調(diào)FOXP3表達(dá),促進(jìn)Treg增殖,增強(qiáng)免疫抑制環(huán)境 [7]。同時(shí),它還與LAG3、NT5E等免疫抑制分子協(xié)同,進(jìn)一步削弱抗腫瘤免疫反應(yīng)。高表達(dá)TNFRSF13B的患者總體生存期與無(wú)進(jìn)展生存期顯著縮短 [7]。
4.3.2 乳腺癌
研究表明,TNFRSF13B表達(dá)與乳腺密度呈負(fù)相關(guān),BMI增加與基因表達(dá)下降顯著相關(guān)(每增加 10 kg/m2,表達(dá)降低 8.5%)[3,5]。由于乳腺密度是乳腺癌的獨(dú)立風(fēng)險(xiǎn)因素,TNFRSF13B可能通過調(diào)控乳腺上皮細(xì)胞的增殖與分化影響癌變風(fēng)險(xiǎn) [5]。此外,其與ESR1、RANK等分子交互作用,可能影響雌激素通路和乳腺組織穩(wěn)態(tài),進(jìn)一步增加腫瘤發(fā)生概率。
4.4 免疫缺陷病
常見變異型免疫缺陷病(CVID)是以B細(xì)胞功能缺陷和抗體生成障礙為特征的原發(fā)性免疫缺陷病。約10%-20%的CVID患者攜帶TNFRSF13B致病性突變(如 A181E、C104R),這些突變削弱TACI與 BAFF/APRIL的結(jié)合能力 [1]。功能上,突變抑制B細(xì)胞活化、免疫球蛋白類別轉(zhuǎn)換及漿細(xì)胞生成,導(dǎo)致患者出現(xiàn)反復(fù)感染和自身免疫性并發(fā)癥。突變型患者更易發(fā)展為慢性肺病和淋巴瘤等嚴(yán)重疾病 [1]。
5. TNFRSF13B(TACI)靶向藥物研究進(jìn)展
當(dāng)前TNFRSF13B(TACI)靶向藥物的研發(fā)呈現(xiàn)出明確的策略趨勢(shì),為克服復(fù)雜疾病的異質(zhì)性和提升療效,“雙靶點(diǎn)”乃至“多靶點(diǎn)”策略已成為該領(lǐng)域的主流方向。這一策略旨在同時(shí)阻斷多條致病通路,或在腫瘤治療中應(yīng)對(duì)抗原逃逸。在腫瘤領(lǐng)域,BCMA/TACI雙靶點(diǎn)CAR-T/CAR-NK細(xì)胞療法正被開發(fā)用于治療多發(fā)性骨髓瘤,以降低單一靶點(diǎn)治療后可能出現(xiàn)的抗原丟失復(fù)發(fā)風(fēng)險(xiǎn)。在自身免疫領(lǐng)域,以恒瑞醫(yī)藥為代表的企業(yè)正積極布局TACI與IL-23、IFNAR-1、BCMA等靶點(diǎn)融合的雙特異性蛋白,旨在通過一個(gè)分子協(xié)同抑制多條炎癥通路,治療系統(tǒng)性紅斑狼瘡等復(fù)雜疾病。盡管多數(shù)項(xiàng)目尚處臨床前階段,但技術(shù)路徑已呈現(xiàn)多元化趨勢(shì)。在研管線總結(jié)如下表:
| 藥物 | 作用機(jī)制 | 藥物類型 | 在研適應(yīng)癥(疾病名) | 在研機(jī)構(gòu) | 最高研發(fā)階段 |
|---|---|---|---|---|---|
| LMY-920 | BAFF-R抑制劑 | BCMA抑制劑 | TACI modulators | 自體CAR-T | 難治性慢性淋巴細(xì)胞白血病 | 復(fù)發(fā)性慢性淋巴細(xì)胞白血病 等 | Luminary Therapeutics, Inc. | The Case Comprehensive Cancer Center | Case Western Reserve University | 臨床1期 |
| BCMA,TACI雙靶向CAR-T(Massachusetts General Hospital) | BCMA調(diào)節(jié)劑 | TACI modulators | CAR-T | 多發(fā)性骨髓瘤 | The Massachusetts General Hospital | 臨床前 |
| IL-12p40/TACI抗體融合蛋白(Jiangsu Hengrui Pharmaceuticals) | IL-12R刺激劑 | TNFRSF13B抑制劑 | 抗體融合蛋白 | 系統(tǒng)性紅斑狼瘡 | 江蘇恒瑞醫(yī)藥股份有限公司 | 臨床前 |
| 抗IL23抗體-TACI融合蛋白(恒瑞醫(yī)藥) | IL-23調(diào)節(jié)劑 | TACI modulators | 抗體融合蛋白 | 系統(tǒng)性紅斑狼瘡 | 江蘇恒瑞醫(yī)藥集團(tuán)有限公司 | 臨床前 |
| Anifrolumb-TACI融合蛋白(恒瑞醫(yī)藥) | IFNAR-1 modulators | TACI modulators | 抗體融合蛋白 | 自身免疫性疾病 | 江蘇恒瑞醫(yī)藥集團(tuán)有限公司 | 臨床前 |
| TST-008 | MASP2抑制劑 | TNFRSF13B抑制劑 | 雙特異性抗體 | 腎臟疾病 | 系統(tǒng)性紅斑狼瘡 | 創(chuàng)勝醫(yī)藥集團(tuán)有限公司 | 臨床前 |
| iPSC CAR-NK TACI/BCMA(Kite Pharma) | BCMA調(diào)節(jié)劑 | TACI modulators | CAR-NK | 多發(fā)性骨髓瘤 | Kite Pharma, Inc. | 臨床前 |
| EPC-004 | BCMA抑制劑 | TACI modulators | 免疫細(xì)胞毒性 | T淋巴細(xì)胞替代物 | CAR-NK | 多發(fā)性骨髓瘤 | Elpis Biopharmaceuticals Corp. | 臨床前 |
| Anti-IFNAR1/ TACI fusion protein(Jiangsu Hengrui Pharmaceutical) | IFNAR-1拮抗劑 | TNFRSF13B抑制劑 | 融合蛋白 | 自身免疫性疾病 | 炎癥 | 江蘇恒瑞醫(yī)藥集團(tuán)有限公司 | 臨床前 |
| Anifrolumb-TACI-BCMA融合蛋白(恒瑞醫(yī)藥) | BCMA調(diào)節(jié)劑 | IFNAR-1 modulators | TACI modulators | 抗體融合蛋白 | 自身免疫性疾病 | 江蘇恒瑞醫(yī)藥集團(tuán)有限公司 | 臨床前 |
| HLX318 | BAFF agonists | BCMA抑制劑 | TACI modulators | 融合蛋白 | 自身免疫性疾病 | 上海復(fù)宏漢霖生物技術(shù)股份有限公司 | 臨床前 |
| SIM0380 | IL-17抑制劑 | TACI modulators | 抗體融合蛋白 | 自身免疫性疾病 | 先聲藥業(yè)集團(tuán)有限公司 | 臨床前 |
| TACI-Fc融合蛋白 (恒瑞醫(yī)藥) | TNFRSF13B抑制劑 | Fc融合蛋白 | 系統(tǒng)性紅斑狼瘡 | 江蘇恒瑞醫(yī)藥股份有限公司 | 臨床前 |
| TACI靶向CAR-T(Massachusetts General Hospital) | TACI modulators | CAR-T | 多發(fā)性骨髓瘤 | The Massachusetts General Hospital | 臨床前 |
| BAFF CAR-T cells(Case Western Reserve University) | BAFF-R抑制劑 | BCMA抑制劑 | TNFRSF13B抑制劑 | CAR-T | 毛細(xì)胞白血病 | Case Western Reserve University School of Medicine | 臨床前 |
(數(shù)據(jù)截止到2025年10月25日,來(lái)源于synapse)
6. TNFRSF13B(TACI)研究工具
TNFRSF13B是TNF受體超家族的關(guān)鍵成員,在免疫調(diào)控及疾病發(fā)生中發(fā)揮重要作用。其通過NF-κB、JAK-STAT等通路調(diào)控免疫穩(wěn)態(tài),但異常表達(dá)或突變與多種疾病密切相關(guān)。華美生物提供TNFRSF13B(TACI)重組蛋白、抗體及ELISA試劑盒產(chǎn)品,助力您開發(fā)特異性靶向TNFRSF13B的藥物,探索其在腫瘤與自身免疫病治療中的應(yīng)用潛力。
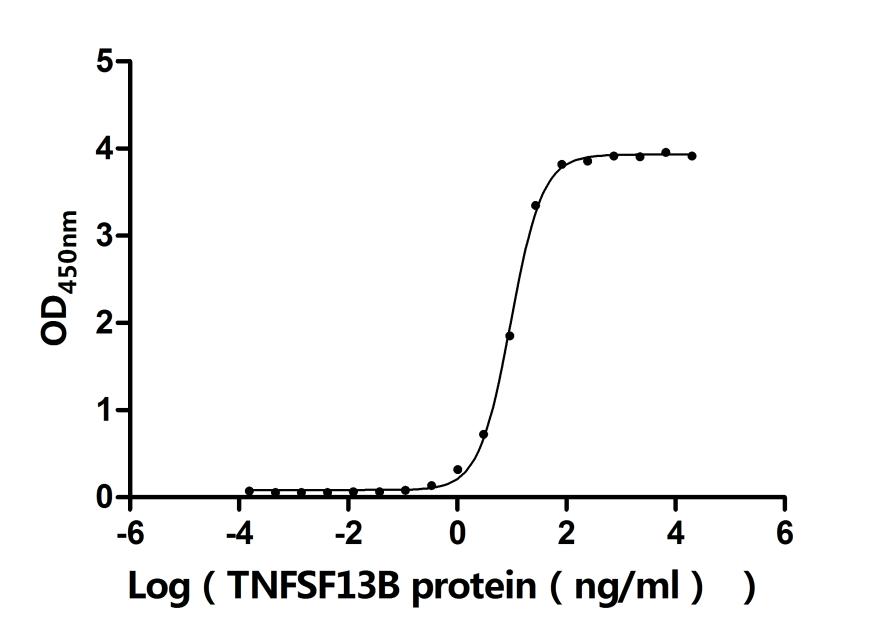
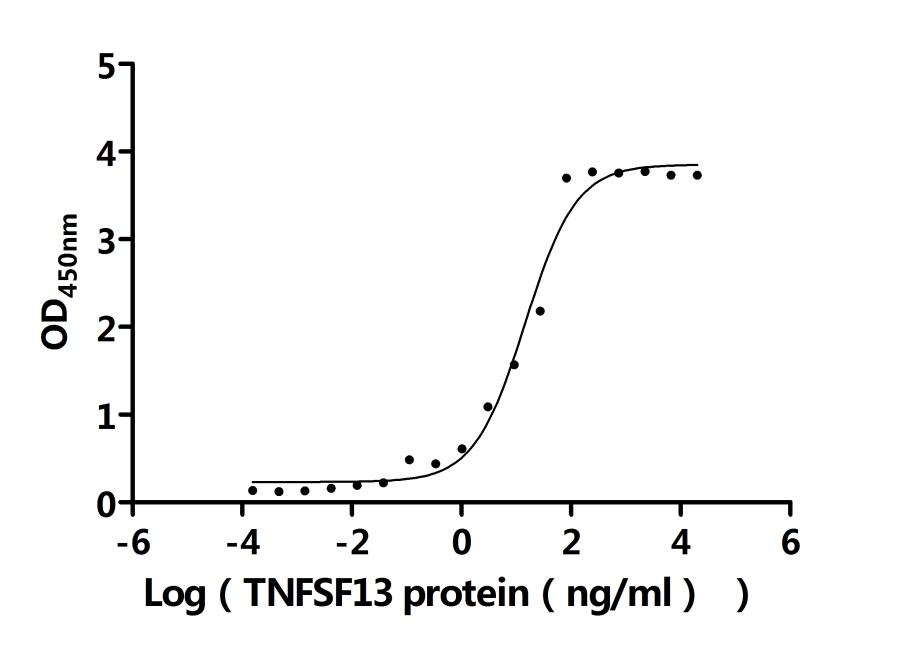
● TNFRSF13B(TACI)重組蛋白

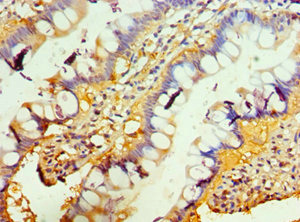
● TNFRSF13B(TACI)抗體
TNFRSF13B Antibody; CSB-PA023971DSR2HU
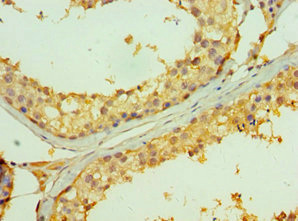
TNFRSF13B Antibody; CSB-PA006292


● TNFRSF13B(TACI) ELISA試劑盒
Human Tumor necrosis factor receptor superfamily member 13B(TNFRSF13B) ELISA kit; CSB-EL023971HU
Mouse Tumor necrosis factor receptor superfamily member 13B(TNFRSF13B) ELISA kit; CSB-EL023971MO
參考文獻(xiàn):
[1] Liquidano-Perez E, et al. Case Report: Hydroa vacciniforme-like lymphoproliferative disorder, an EBV-associated disease, successfully treated with hematopoietic stem cell transplantation. Front Immunol. 2025;16:1511385.
[2] Lee S-M, et al. Cell to Cell Interaction Can Activate Membrane-bound APRIL Which Are Expressed on Inflammatory Macrophages. Immune Netw. 2010;10 (5):173-180.
[3] Han Y, et al. Changes in adiposity over the life course and gene expression in postmenopausal women. Cancer Med. 2022;11:2699-2710.
[4] Aguirre-Valencia D, et al. Expression of BAFF, APRIL, and cognate receptor genes in lupus nephritis and potential use as urinary biomarkers. J Transl Autoimmun. 2020;3:100027.
[5] Mintz R, et al. Hormone and receptor activator of NF-κB (RANK) pathway gene expression in plasma and mammographic breast density in postmenopausal women. Breast Cancer Res. 2022;24:28.
[6] Rohan P, et al. NF-ΚB Activation as a Key Driver in Chronic Lymphocytic Leukemia Evolution to Richter's Syndrome: Unraveling the Influence of Immune Microenvironment Dynamics. Genes. 2024;15:1434.
[7] Zhang C, et al. Pivotal factors associated with the immunosuppressive tumor microenvironment and melanoma metastasis. Cancer Med. 2021;10:4710-4720.
[8] Reis BCSD, et al. Rare genetic variants involved in multisystem inflammatory syndrome in children: a multicenter Brazilian cohort study. Front Cell Infect Microbiol. 2023;13:1182257.












