CDH6靶向藥物研究進展:多藥企齊發力,開啟腫瘤治療新希望
日期:2024-12-18 13:42:15
最近,CDH6靶向藥物的研究領域迎來了一系列重要進展。第一三共(中國)宣布其CDH6靶向抗體偶聯藥物R-DXd的國際多中心II/III期臨床研究在中國完成了首例患者給藥,這標志著R-DXd成為中國首個進入II/III期研究的CDH6靶向ADC藥物。R-DXd在首次人體研究中顯示出具有前景的臨床療效,期待通過II/III期研究進一步明確其在鉑耐藥晚期卵巢癌患者中的療效。同時,普眾發現與Adcendo ApS達成了一項價值超過10億美元的全球獨家開發和商業化協議,針對其新型ADC藥物ADCE-T02(AMT-754),該藥物以其獨特的抗體設計和先進的連接子-有效載荷技術,展現出提高臨床療效和安全性的潛力。此外,先聲藥業的CDH6 ADC藥物SIM0505的臨床試驗申請也獲得了中國國家藥品監督管理局(NMPA)的受理,成為繼昂闊醫藥的CDH6 ADC之后,又一款國產CDH6 ADC進入臨床階段的藥物。這些突破性進展不僅突顯了CDH6作為腫瘤治療新靶點的重要性,也為患者帶來了更多治療上的新希望。
1. CDH6簡介
CDH6(鈣粘蛋白-6或K-鈣粘蛋白)是一種屬于II型經典鈣粘蛋白家族的單次跨膜蛋白,由790個氨基酸構成,包含胞外結構域、跨膜區和胞內尾巴。其基因位于人類第五號染色體上,主要在上皮細胞的基底外膜中發揮重要作用,負責介導鈣依賴性的細胞間粘附,維持組織的完整性和正常的細胞排列。在正常生理狀態下,CDH6通過胞外結構域與相鄰細胞上的CDH6或其他鈣粘蛋白相互作用,但在多種惡性腫瘤中,如卵巢癌和腎細胞癌,其表達顯著上調,并與不良預后相關。CDH6的功能異常可能影響腫瘤細胞的浸潤、轉移及復發,因此成為抗癌研究的熱門靶點。目前,針對CDH6的抗體藥物偶聯物(ADC)正在開發中,例如第一三共的DS-6000a和昂闊醫藥的CUSP06,這些藥物在臨床試驗中顯示出良好的療效,為腫瘤治療提供了新的希望 [1]。
2. CDH6在腫瘤中的調控機制
CDH6在腫瘤中的調控機制主要涉及其在細胞間粘附和信號傳遞中的作用。研究發現,CDH6通過與整合素αIIbβ3和α2β1相互作用激活SRC、FAK、AKT、ERK等關鍵信號通路。例如,SRC和FAK在細胞粘附和遷移中發揮重要角色,CDH6通過激活這些通路促進腫瘤細胞的遷移和浸潤;AKT作為主要的生存信號通路,其激活能夠抑制細胞凋亡,從而促進腫瘤細胞的存活;而ERK信號通路則與細胞增殖密切相關,CDH6通過此途徑進一步促進腫瘤細胞的增殖。此外,在腫瘤微環境中,CDH6還可能通過影響免疫細胞的功能來促進腫瘤進展。研究顯示,CDH6可以調節腫瘤相關巨噬細胞(TAM)的極化狀態,使其向促腫瘤表型轉變。這種極化狀態可能導致免疫抑制環境的形成,從而幫助腫瘤逃避免疫監視。因此,CDH6不僅在腫瘤細胞的生物學行為中發揮重要作用,也為癌癥治療中的重要靶點(圖1)[2-3]。
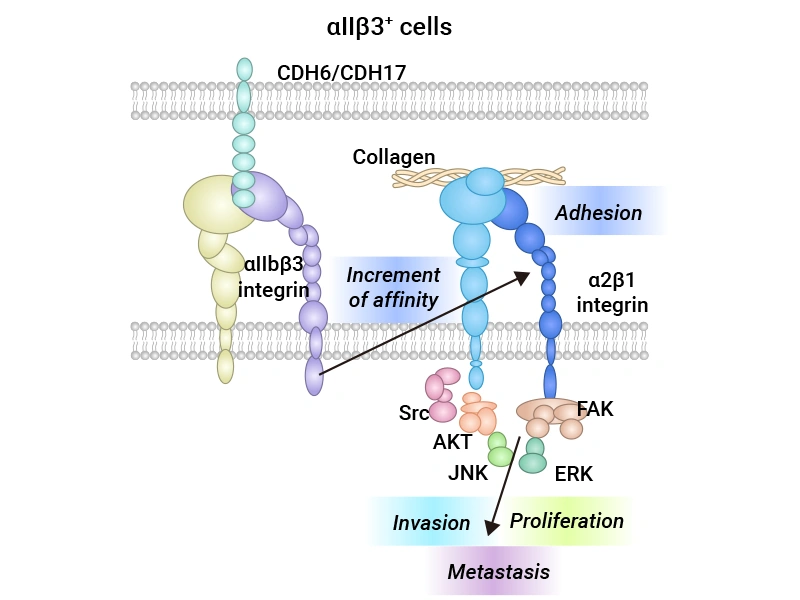
圖1. CDH6在腫瘤中的調控機制 [3]
3. CDH6和多種腫瘤密切相關
3.1 腎癌
CDH6在腎癌中的研究越來越受到重視。研究表明,CDH6在腎細胞癌(RCC)中高表達,這種表達與腫瘤的生長和轉移相關。CDH6的過度表達被認為是腎癌細胞侵襲性增強的重要因素之一。Rubén A. Bartolomé等人的研究指出,CDH6通過與整合素(如αIIbβ3和α2β1)的相互作用,促進細胞粘附、遷移和增殖,從而可能導致癌細胞的轉移性播散。針對CDH6的抗體藥物偶聯物(ADC)正在開發中,其中Raludotatug Deruxtecan(DS-6000a)是一款針對CDH6的ADC藥物,在臨床前研究中顯示出對卵巢癌和腎癌模型的有效性。此外,另一款名為CUSP06的CDH6 ADC也正在研發中,其在體外對多種CDH6陽性癌細胞系表現出強大的抗增殖活性。CDH6不僅成為理解腎癌生物學的重要分子,也為未來靶向治療提供了新的機會 [4-6]。
3.2 卵巢癌
CDH6在卵巢癌中表現出高表達,與疾病進展和較低的生存率相關。初步研究顯示,DS-6000a在治療鉑耐藥的晚期卵巢癌患者中展現了良好的安全性和有效性。在一項I期臨床試驗中,患者的客觀緩解率達到46%,疾病控制率高達98%。在2023年歐洲腫瘤內科學會(ESMO)上公布的數據表明,DS-6000a在既往接受過多種治療的卵巢癌患者中表現出持續的臨床療效。患者的中位緩解持續時間為11.2個月,這為CDH6作為治療靶點提供了進一步支持。當前,針對CDH6的ADC藥物正在進行更多臨床試驗,以驗證其長期療效和安全性。這些研究不僅為卵巢癌患者提供了新的希望,也為其他高表達CDH6的腫瘤類型的治療開辟了新的方向 [7-8]。
3.3 其它腫瘤
CDH6基因在多種癌癥中呈現異常表達,特別是在卵巢癌和腎癌中其表達水平較高,并與不良預后相關聯。除了這兩種癌癥外,CDH6在膽管癌、胃癌、甲狀腺癌、肝細胞癌和小細胞肺癌等多種惡性腫瘤中也被發現表達量增加。CDH6的高表達與腫瘤細胞的生長和增殖密切相關,它參與了細胞間的粘附、器官的發育過程以及上皮-間質轉化等關鍵生物學過程。鑒于CDH6在腫瘤組織中的高表達與正常組織中的低表達之間的差異,它被視為一個潛在的治療靶點,尤其在抗體藥物偶聯物(ADC)的開發中展現出巨大潛力。目前,CDH6作為治療靶點的重要性正在日益增加,預計未來將為多種癌癥患者提供新的治療選項 [9-11]。
4. 藥物研究進展
CDH6作為臨床藥物研究的新焦點,正在腫瘤治療中顯示出應用潛力。目前,以ADC抗體偶聯藥物為主的在研藥物有DS-6000、AMT-707(CUSP06)和SIM0505,其在研適應癥主要聚焦于腫瘤領域,包括某些類型的腎癌、卵巢癌等 (表1)。作用機制上,這些藥物主要通過阻斷CDH6介導的細胞間黏附或信號傳導通路,抑制腫瘤細胞的增殖、遷移與侵襲等惡性行為。DS-6000(Raludotatug deruxtecan,R-DXd)由第一三共研發,是一款基于DXd技術平臺的抗體偶聯藥物(ADC),2023年默沙東與第一三共達成合作,以高達220億美元的總交易額獲得包括DS-6000在內的三款ADC的全球開發和商業化權益,DS-6000已處于臨床2/3階段,用于治療既往接受過至少一線全身抗癌治療的鉑耐藥高級別卵巢癌、原發性腹膜癌或輸卵管癌患者。AMT-707(CUSP06)由普眾發現(Multitude Therapeutics)與昂闊醫藥(Oncusp Therapeutics)共同開發,目前處于臨床1期。SIM0505是先聲藥業申報的首款CDH6 ADC,目前處于臨床申請階段,其臨床試驗申請已獲得NMPA受理。盡管CDH6藥物研發尚處于早期,但隨著研究的不斷深入,預期將在腫瘤精準治療領域實現突破,為癌癥治療提供新的解決方案。
| 藥物 | 靶點(基因名) | 藥物類型 | 在研適應癥(疾病名) | 在研機構 | 最高研發階段 |
|---|---|---|---|---|---|
| Raludotatug deruxtecan | CDH6 x TOP1 | ADC | 輸卵管癌 | 鉑耐藥性輸卵管癌 | 鉑耐藥性卵巢癌 | 原發性腹膜癌 | 局部晚期惡性實體瘤 | 轉移性實體瘤 | 晚期腎細胞癌 | 卵巢癌 | 晚期惡性實體瘤 | 鉑類耐藥性原發性腹膜癌 | 卵巢上皮癌 | Daiichi Sankyo Co., Ltd. | 第一三共(中國)投資有限公司 | Daiichi Sankyo Propharma Co., Ltd. | Merck Sharp & Dohme LLC | Daiichi Sankyo, Inc. | Merck & Co., Inc. | 臨床2/3期 |
| CUSP06 | CDH6 x TOP1 | ADC | 晚期惡性實體瘤 | 鉑耐藥性卵巢癌 | 實體瘤 | OnCusp Therapeutics | 普眾發現醫藥科技(上海)有限公司 | 臨床1期 |
| SIM-0505 | CDH6 x TOP1 | ADC | 實體瘤 | 先聲藥業集團有限公司 | 上海先祥醫藥科技有限公司 | 臨床申請 |
| ATG-106 | CD3 x CDH6 | 雙特異性抗體 | 血液腫瘤 | 實體瘤 | 德琪(浙江)醫藥科技有限公司 | 臨床前 |
| SY2023 | CDH6 | 抗體 | 腫瘤 | 上海祥耀生物科技有限責任公司 | 臨床前 |
| CDH6-RGD (Protein Alternatives) | CDH6 | 單克隆抗體 | 腎腫瘤 | 卵巢癌 | Protein Alternatives SL | 藥物發現 |
| WO2024165049 | CDH6 | 單克隆抗體 | 腫瘤 | 山東先聲生物制藥有限公司 | 藥物發現 |
| Raludotatug | CDH6 | 單克隆抗體 | 腫瘤 | / | 臨床階段不明 |
表1:CDH6臨床部分在研藥物
5. 產品推薦
為協助各藥企針對CDH6在癌癥臨床中的研究,特別是CDH6腎癌、卵巢癌免疫治療應用領域,華美CUSABIO重磅推出多款高活性的 CDH6 蛋白產品,助力您在CDH6機制方面的研究或其潛在臨床價值的探索。華美CUSABIO通過提供高質量的蛋白產品,致力于推動相關領域的科學研究和藥物開發,加速創新療法的進展。
華美CUSABIO蛋白CDH6
● Recombinant Human Cadherin-6(CDH6),partial (Active) (Code: CSB-MP005055HU1)
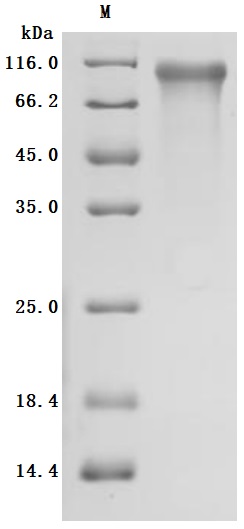
Purity ≥ 95% validated by SDS-PAGE
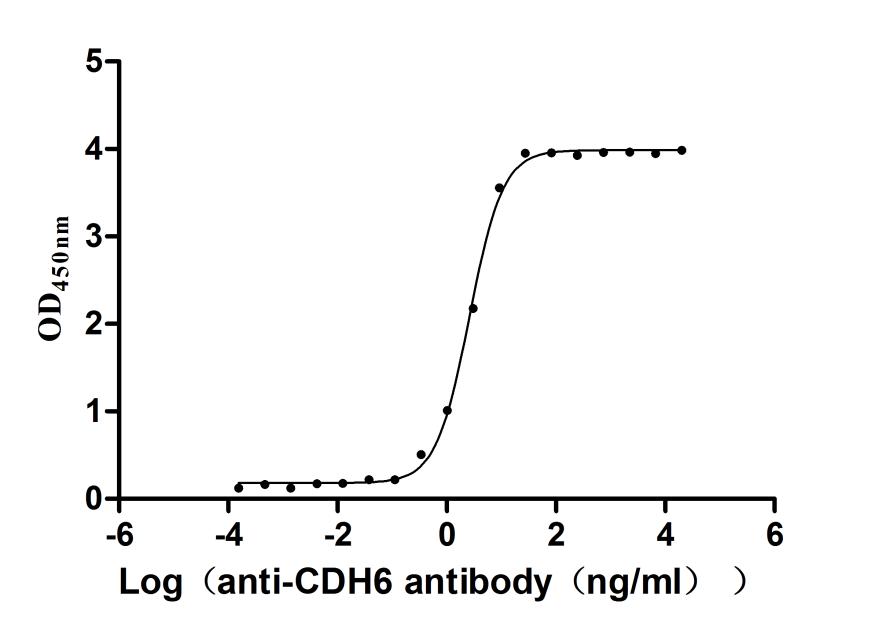
Activity Measured by its binding ability in a functional ELISA: Immobilized Human CDH6 at 2μg/mL can bind Anti-CDH6 recombinant antibody (CSB-RA005055MA1HU),the EC50 is 2.421-2.802 ng/mL.
● Recombinant Mouse Cadherin-6(Cdh6),partial (Active) (Code: CSB-MP005055MO1)
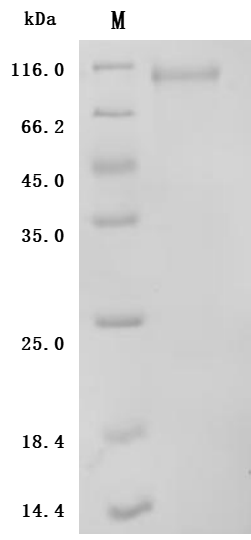
Purity ≥ 95% validated by SDS-PAGE
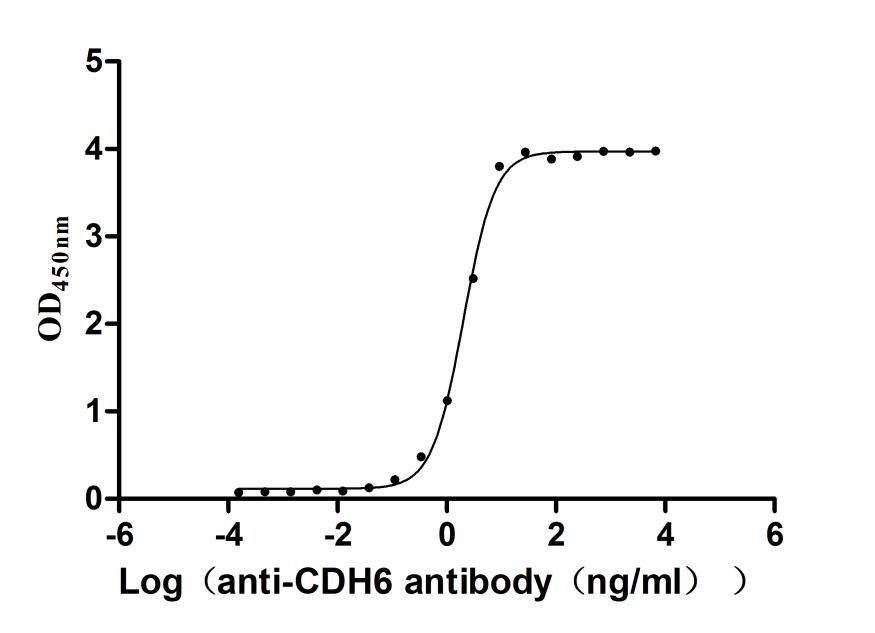
Activity Measured by its binding ability in a functional ELISA. Immobilized Mouse CDH6 at 2 μg/ml can bind Anti-CDH6 recombinant antibody (CSB-RA005055MA1HU). The EC50 is 1.884-2.164 ng/mL.
● Recombinant Macaca fascicularis Cadherin 6(CDH6),partial (Active) (Code: CSB-MP4958MOV)

Purity ≥ 95% validated by SDS-PAGE

Activity Measured by its binding ability in a functional ELISA: Immobilized Macaca fascicularis CDH6 at 2μg/mL can bind Anti-CDH6 recombinant antibody (CSB-RA005055MA1HU),the EC50 is 2.076-2.371 ng/mL.
● Recombinant Rat Cadherin-6(Cdh6),partial (Active) (Code: CSB-MP005055RA1)
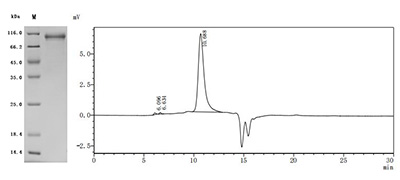
Purity ≥ 95% validated by SDS-PAGE and SEC-HPLC.

Activity Measured by its binding ability in a functional ELISA: Immobilized Rat CDH6 at 2 μg/ml can bind Anti-CDH6 recombinant antibody (CSB-RA005055MA1HU). The EC50 is 1.630-1.837 ng/mL.
參考文獻:
[1] Sch?ffski, Patrick, et al. "A phase 1 study of a CDH6-targeting antibody-drug conjugate in patients with advanced solid tumors with evaluation of inflammatory and neurological adverse events." Oncology research and treatment 44.10 (2021): 547-556.
[2] Gugnoni, M., et al. "Cadherin-6 promotes EMT and cancer metastasis by restraining autophagy." Oncogene 36.5 (2017): 667-677.
[3] Bartolomé, Rubén A., et al. "CDH6‐activated αIIbβ3 crosstalks with α2β1 to trigger cellular adhesion and invasion in metastatic ovarian and renal cancers." Molecular Oncology 15.7 (2021): 1849-1865.
[4] Collins, Scott D., et al. "Targeting cadherin-6 (CDH6) with an antibody-drug conjugate for the treatment of ovarian and renal cancer." Cancer Research 76.14_Supplement (2016): 2974-2974.
[5] Suzuki, Hirokazu, et al. "Raludotatug Deruxtecan, a CDH6-Targeting Antibody–Drug Conjugate with a DNA Topoisomerase I Inhibitor DXd, Is Efficacious in Human Ovarian and Kidney Cancer Models." Molecular cancer therapeutics 23.3 (2024): 257-271.
[6] Marable, Sierra S., Eunah Chung, and Joo-Seop Park. "Page Title: Hnf4a is required for the development of Cdh6-expressing progenitors into proximal tubules in the mouse kidney."
[7] Suzuki, H., et al. "10P DS-6000a, a novel CDH6-targeting antibody-drug conjugate with a novel DNA topoisomerase I inhibitor DXd, demonstrates potent antitumor activity in preclinical models." Annals of Oncology 32 (2021): S363-S364.
[8] Hamilton, Erika P., et al. "Phase I, two-part, multicenter, first-in-human (FIH) study of DS-6000a in subjects with advanced renal cell carcinoma (RCC) and ovarian tumors (OVC)." (2022): 3002-3002.
[9] Meng, Ming, et al. "CDH6 as a prognostic indicator and marker for chemotherapy in gliomas." Frontiers in genetics 13 (2022): 949552.
[10] Zhao, Zongxian, et al. "High expression of oncogene cadherin-6 correlates with tumor progression and a poor prognosis in gastric cancer." Cancer Cell International 21 (2021): 1-9.
[11] Gugnoni, M., et al. "Cadherin-6 promotes EMT and cancer metastasis by restraining autophagy." Oncogene 36.5 (2017): 667-677.
上一篇: 前沿靶點速遞:每周醫學研究精選(二十二)
下一篇: 前沿靶點速遞:每周醫學研究精選(二十三)












