多功能分子-CD31
日期:2019-08-29 11:31:08
CD31抗原,又稱為血小板內(nèi)皮細(xì)胞黏附分子(PECAM-1),是相對分子質(zhì)量為130kDa 的I 型跨膜糖蛋白,屬于免疫球蛋白超家族成員,可在內(nèi)皮細(xì)胞、循環(huán)的血小板、單核細(xì)胞、中性細(xì)胞及T細(xì)胞亞群表面表達(dá)。在2015年ASCO會議上,Michael J. Birrer, MD團(tuán)隊結(jié)合他們的研究提出CD31是卵巢癌中貝伐單抗療效的潛在標(biāo)志物。因為貝伐單抗對無進(jìn)展生存期和總生存期的影響在高CD31的患者中最為明顯。這一發(fā)現(xiàn)再次引起了國內(nèi)外學(xué)者對CD31的關(guān)注。本文就CD31的定義、結(jié)構(gòu)、共受體、功能、信號通路及相關(guān)疾病進(jìn)行簡單介紹。
1. 什么是CD31?
CD31是是由位于17號染色體長臂末端的75kb基因編碼的跨膜糖蛋白。CD31最早是Newman及其同事于1990年發(fā)表于Science上的一篇報告中提出。該文通過血小板整膜糖蛋白抗體結(jié)合實驗發(fā)現(xiàn)了新的免疫球蛋白超家族細(xì)胞粘附分子(cell adhesion molecule,CAM)成員即是曾經(jīng)確定為CD31的粒一單核細(xì)胞分化抗原[1] [2] [3]。
細(xì)胞粘附分子(CAM)是參與細(xì)胞與細(xì)胞之間及細(xì)胞與細(xì)胞外基質(zhì)之間相互作用的分子。可大致分為五類:鈣粘素(cadherin)、選擇素(selectin)、免疫球蛋白超家族(IgSF)、整合素(integrin)及透明質(zhì)酸粘素(hyaladherin)。免疫球蛋白超家族中的細(xì)胞粘附分子還有各種神經(jīng)細(xì)胞粘附分子(N-CAM),細(xì)胞問粘附分子(I-CAM)及脈管細(xì)胞粘附分子(V-CAM)等,其中N-CAM和CD31屬于親同性CAM(兩相鄰細(xì)胞表面的同種CAM分子間的相互識別與結(jié)合);I-CAM和V-CAM屬于親異性CAM(兩相鄰細(xì)胞表面的不同種CAM分子間的相互識別與結(jié)合)。
2. CD31的結(jié)構(gòu)
CD31是分子量為130kDa的跨膜糖蛋白。由于糖基化差異在不同細(xì)胞類型中分子有些許不同。人的CD31蛋白包含三個結(jié)構(gòu)域,分別是胞外結(jié)構(gòu)域,跨膜結(jié)構(gòu)域和胞內(nèi)結(jié)構(gòu)域。其中,胞外結(jié)構(gòu)域由574個氨基酸組成,跨膜結(jié)構(gòu)域包含19個疏水氨基酸,胞內(nèi)結(jié)構(gòu)域包含118個氨基酸。功能區(qū)主要集中在胞外結(jié)構(gòu)域和胞內(nèi)結(jié)構(gòu)域。結(jié)構(gòu)如圖一所示:
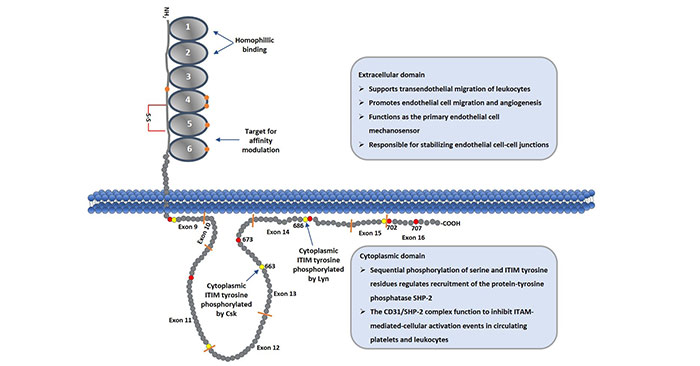
圖1 Schematic Diagram of CD31 Protein
2.1 胞外結(jié)構(gòu)域
CD31的胞外部分,除了信號肽之外,剩余的氨基酸形成6個免疫球蛋白亞單位組成的同源區(qū),每個同源區(qū)由一個單獨(dú)的外顯子編碼,并借助半胱氨酸殘基形成的二硫鍵組成保守的IgC2型亞單位, 每個亞單位約含100個氨基酸殘基。
CD31胞外區(qū)的第一、二免疫球蛋白樣區(qū)(IgD1和IgD2)為嗜同種性粘附的結(jié)合位點,共同介導(dǎo)嗜同種性粘附,第六免疫球蛋白樣區(qū)可調(diào)節(jié)CD31的粘附表型。增加受體與配體之間的第一、二免疫球蛋白樣區(qū)的親和力;CD31胞外區(qū)的第二免疫球蛋白樣區(qū)為異嗜性粘附的結(jié)合位點,第二免疫球蛋白樣區(qū)的肝素結(jié)合序列可介導(dǎo)異嗜粘附,且依賴于氨基葡聚糖的存在[4]。
2.2 胞內(nèi)結(jié)構(gòu)域
CD31胞內(nèi)結(jié)構(gòu)域的結(jié)構(gòu)是由二維核磁共振確定,含有由非控制區(qū)域隔開的兩個脂質(zhì)相關(guān)區(qū)域。CD31基因通常由16額外顯子組成(每個外顯子之間由內(nèi)含子隔開)。該結(jié)構(gòu)域由8個外顯子組成(如figure1所示)。
CD31胞內(nèi)結(jié)構(gòu)域含有兩個共有序列,分別形成兩個免疫受體酪氨酸抑制基序(ITIM),是含有SH2的酪氨酸磷酸酶2(SHP-2)停泊的特異位點,這兩個特定的酪氨酸為Y663和Y686。SHP-2與磷酸化的Y663和Y686的結(jié)合引發(fā)反饋抑制性信號轉(zhuǎn)導(dǎo)的發(fā)生,從而具有多種生理效應(yīng)。CD31的胞內(nèi)區(qū)含有12個Ser殘基,4個Thr殘基,5個Tyr殘基。這些都是可進(jìn)行磷酸化的位點。
通過編碼胞漿區(qū)的變化性拼接可產(chǎn)生異構(gòu)的CD31,因為異構(gòu)的CD31可含有(或無)上述位點的氨基酸殘基,所以可產(chǎn)生不同表型的CD31。胞漿區(qū)有助于CD31定位于細(xì)胞間連接和介導(dǎo)細(xì)胞間粘附,去除部分胞漿區(qū)可明顯改變CD31的結(jié)合特性,使得CD31介導(dǎo)的粘附性由異嗜性向同種性轉(zhuǎn)變[5] [6]。
3. CD31的共受體
大量研究證實CD31的共受體之一是其本身。親和作用力通常是由CD31分子的第一和第二C2結(jié)構(gòu)域(胞外第一和第二個IgD結(jié)構(gòu)域)介導(dǎo)。另外,整聯(lián)素的IgSF/CAM也可以與CD31結(jié)合,目前已證實的CD31共受體整聯(lián)蛋白是αvβ3(或CD51 / CD61)整聯(lián)蛋白。 盡管整聯(lián)蛋白在T細(xì)胞,NK細(xì)胞,肥大細(xì)胞和內(nèi)皮上表達(dá),但它作為IgSF配體有點不尋常,因為所有其他ICAM / VCAM受體都是β1,β2或β7整聯(lián)蛋白類型。
4. CD31的功能
CD-31 通常位于血管內(nèi)皮細(xì)胞、血小板、巨噬細(xì)胞和kuffer細(xì)胞、粒細(xì)胞、T/NK細(xì)胞、淋巴細(xì)胞、巨核細(xì)胞、破骨細(xì)胞、嗜中性粒細(xì)胞。在某些腫瘤也發(fā)現(xiàn)CD31的表達(dá),如上皮樣血管內(nèi)皮瘤、上皮樣肉瘤樣血管內(nèi)皮瘤、其他血管腫瘤、組織細(xì)胞性惡性腫瘤和漿細(xì)胞。在循環(huán)血小板和白細(xì)胞中,CD31主要是通過調(diào)節(jié)其胞內(nèi)結(jié)構(gòu)域磷酸化順序而限制細(xì)胞活化反應(yīng),通常是作為抑制性受體起作用。 另外,D31也在內(nèi)皮細(xì)胞細(xì)胞間連接處高度表達(dá),作為機(jī)械傳感器,白細(xì)胞運(yùn)輸?shù)恼{(diào)節(jié)劑和維持內(nèi)皮細(xì)胞連接完整性起作用。
與CD31相關(guān)的大多數(shù)活性可歸因于嗜同性CD31-CD31相互作用。其中包括白細(xì)胞外滲、骨髓造血和血管發(fā)育。CD31可以促進(jìn)各種白細(xì)胞相關(guān)整聯(lián)蛋白與ICAM/VCAM IgSF成員的結(jié)合,并幫助外周血白細(xì)胞穿過內(nèi)皮屏障。促進(jìn)CAM-IgSF結(jié)合是由于白細(xì)胞CD31-內(nèi)皮細(xì)胞CD31參與后,β1和β2整聯(lián)蛋白活性的普遍上調(diào)引起的。
5. CD31信號傳導(dǎo)
如2.2部分所述,胞內(nèi)結(jié)構(gòu)域中存在許多絲氨酸、蘇氨酸和酪氨酸殘基。CD31介導(dǎo)的信號傳導(dǎo)通常是由702位絲氨酸的磷酸化引發(fā),然后與質(zhì)膜結(jié)合釋放ITIM的686位酪氨酸,進(jìn)而磷酸化Src-家族激酶Lyn。此外,ITIM的663位酪氨酸會繼續(xù)發(fā)生順序磷酸化。一旦ITIM的663位酪氨酸完成磷酸化,CD31會募集Src同源性2結(jié)構(gòu)域蛋白,比如酪氨酸磷酸酶SHP-2。
2010年,F(xiàn)ederica M. Marelli-Berg團(tuán)隊的一項研究揭示了T細(xì)胞中CD31作用機(jī)制。在初始T細(xì)胞中,細(xì)胞表面CD31表達(dá)下調(diào)與穩(wěn)態(tài)增殖有關(guān),當(dāng)胸腺流出減少時,CD31負(fù)責(zé)維持T細(xì)胞庫中T細(xì)胞含量的穩(wěn)定。而在記憶T細(xì)胞中,CD31調(diào)節(jié)記憶T細(xì)胞的流量,但不影響它們的激活[7]。
CD31最顯著的特征是在其細(xì)胞質(zhì)結(jié)構(gòu)域中存在兩個ITIM。這些ITIM在TCR活性后磷酸化,隨后募集蛋白酪氨酸磷酸酶(PTP),例如Src同源性2(SH2),抑制TCR信號傳導(dǎo)。如圖2所示[8]:
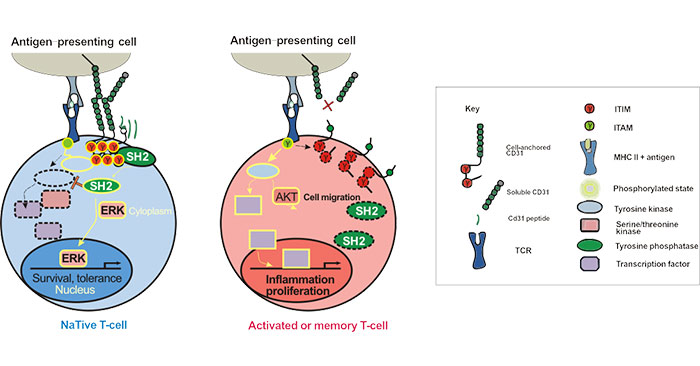
圖2 CD31 Signaling Pathways in T-lymphocytes
6. CD31相關(guān)疾病
CD31可在所有白細(xì)胞中表達(dá),包括T細(xì)胞、B細(xì)胞和樹突細(xì)胞。CD31復(fù)雜的生物學(xué)功能主要源于其在免疫和血管系統(tǒng)中粘附和信號傳導(dǎo)功能的整合。CD31的異常表達(dá)可引發(fā)多種疾病,例如動脈粥樣硬化、炎癥和血液病等。
6.1、CD31與動脈粥樣硬化
在動脈粥樣硬化的過程中,CD31的作用主要表現(xiàn)在對冠狀斑塊穩(wěn)定性的影響。在心肌梗塞(MI)病人中,血小板CD31復(fù)合物濃度是升高的,而在動物模型中梗死區(qū)抗CD31抗體的濃度是下降的[9]。在延遲或失敗的溶栓病人中血小板CD31復(fù)合物表達(dá)是增高的。另外,有研究證實過氧化物酶有抗血管氧化的作用,而CD31則影響酶與內(nèi)皮的接觸,從而起到機(jī)械性控制粥樣硬化的進(jìn)程。所以推測CD31基因變異在冠心病的進(jìn)展中有深遠(yuǎn)的影響。此外,研究發(fā)現(xiàn)心絞痛,急性心肌梗死,心源性休克,猝死等均好發(fā)于清晨6時到12時這段時間。這與CD31的水平在夜晚和清晨達(dá)高峰有一定時間上的吻合性[10]。
6.2 CD31與炎癥
大量研究數(shù)據(jù)表明,在急性腹膜炎、急性肺損傷、心肌缺血再灌注損傷和皮膚炎癥模型中,CD31抗體可阻斷中性粒細(xì)胞和單核細(xì)胞的募集。Steren等人報道稱,在抗CD31抗體處理的鼠腸系膜靜脈中,白細(xì)胞位于血管腔面,但不能外滲。其中一些研究也存在分歧,Gza.Rlek等發(fā)現(xiàn),在鼠的急性胰腺炎模型中,大部分粘附、活化和遷移的白細(xì)胞都伴有氧自由基的釋放,而Murat.Turegun等研究發(fā)現(xiàn),在獵的心肌缺血再滔注損傷模型中.抗CD31抗體不能顯著抑制中性粒細(xì)胞釋放氧自由基[11]。
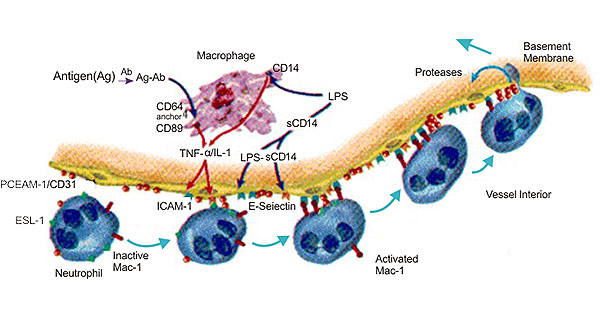
圖3 The Diagram of CD31 and Inflammation
在炎癥反應(yīng)中,白細(xì)胞與內(nèi)皮細(xì)胞之間的相互作用是關(guān)鍵環(huán)節(jié),它使得白細(xì)胞進(jìn)入炎癥部位并引起組織損傷。CD31特異地定位于血管內(nèi)皮細(xì)胞腔面?zhèn)鹊臐{膜,參與不同類型白細(xì)胞外滲的最后步驟。因此CD31在炎癥微循環(huán)損傷中有重要作用,但作用機(jī)制尚未弄清楚,還需進(jìn)一步研究[12] [13]。
6.3 CD31與血液疾病
Karen Ballen[14]等人發(fā)現(xiàn),在再生障礙貧血患者外周血及骨髓中,再障組骨髓及外周血單個核細(xì)胞CD31、CD44抗原水平明顯低于正常對照組。而且相關(guān)分析發(fā)現(xiàn),骨髓、外周血單個核細(xì)胞CD31、CD44水平與外周血白細(xì)胞數(shù)、血紅蛋白、血小板,骨髓中粒系比例、紅系比例、巨核細(xì)胞均呈正相關(guān)。這些數(shù)據(jù)表明粘附分子表達(dá)異常可能在再障發(fā)病中起一定作用。
根據(jù)Gordon等[15]的研究可推測,細(xì)胞粘附分子能夠提示瞄定位點,從而使初始造血細(xì)胞粘附到骨髓基質(zhì),并提供調(diào)節(jié)信號,從而使初始造血細(xì)胞從骨髓釋放前進(jìn)一步分化。認(rèn)為再障三系減少與粘附分子表達(dá)缺陷密切相關(guān),是再障造血衰竭的重要因素之一。但其確切作用機(jī)制仍需要進(jìn)一步的探討。
Reference:
[1] 10hto, H., Maeda, H., et al. Blood. 1985, 66,873-88.
[2] AIbelda, S.M., Oliver, P.D., et al. J. Cell Biol. 1990, 110, 1227-1237.
[3] Horace M. DeLisser, Peter J. Newman, et al. Molecular and functional aspects of PECAM-I/CD31 [J]. Immunology Today. 1994, 15(10):490-495.
[4] Paddock C, Zhou D, et al. Structural basis for PECAM-1 homophilic binding [J]. Blood. 2016, 127:1052–1061.
[5] Paddock C, Lytle BL, et al. Residues within a lipid-associated segment of the PECAM-1 cytoplasmic domain are susceptible to inducible, sequential phosphorylation [J]. Blood. 2011, 117:6012–6023.
[6] Panida Lertkiatmongkol, Danying Liao, et al. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31) [J]. Vascular biology. 2016, 23(3):253-259.
[7] Manes, T. D., Hoer, S., et al. Kaposis sarcoma-associated herpesvirus K3 and K5 proteins block distinct steps in transendothelial migration of effector memory CD4+ T cells by targeting different endothelial proteins [J]. J. Immunol. 2010, 184, 5186–5192.
[8] Federica M. Marelli-Berg, Marc Clement, et al. An immunologists guide to CD31 function in T-cells [J]. Journal of Cell Science. 2013, 126: 2343-2352.
[9] Nounhargh S.Krombach F, et al. The role of JAM-A and PECAM?l in modulating leukocyte infiltration in inflamed and ischemic tissues [J]. J Lonkoc Biol. 2006, 80(4):714—718.
[10] Kalinowska A,Losy J.PECAM-1,a key player in neuro-inflammation[J]. Eur J Neurol. 2006, 13(12):1284-1290.
[11] Dangerfiled J, Larbi KY, et al. PECAM-1(CD31) hemophilic interaction up-regulated α6β1 on transmigrated neutrophils in vivo and play a functional role in the ability of α6 integrins to mediate leukocyte migration through the perivascular basement membrane [J]. J Exp Med. 2002, 196(9): 1201-1211.
[12] Ostermann G, Weber KSC, et al. JAM-1 is a ligand of the β2 intergrin LFA-1 involved in transendothelial migration of leukocytes [J]. Nature Immunol. 2002, 3(2):151-158.
[13] Schenkel AR, Mamdouh Z, et al. CD99 plays a major role in the migration of monocytes through endothelial junctions [J]. Nature Immunol. 2002, 3(2):143-150.
[14] Karon Ballen, Pamela S, et al.Effect of ex vivo cytokine treatment on human cord blood engraftment in NODseid mice[J].Br J Haematol. 2001, 108(3):629-640.
[15] Gordon MY, Clark D, et al. Hemopoietic progenitor cell binging to the stromal microenvironment in vitro [J]. Exp Hematol. 1990, 18(7):837.
下一篇: 生長激素-不僅僅促進(jìn)長高















